Устойчивост на микроорганизми, причинени от бета-лактамази, както и начини за нейното преодоляване,
микробната устойчивост, причинени от бета-лактамази, както и начини за нейното преодоляване
Понастоящем антибиотици бета-лактамни са най-често използваните лекарства за лечение на бактериални инфекции, но тяхната ефективност може да се намали поради появата на стабилност към тях, най-често механизъм за развитието на който е производството на бета-лактамази. За да се преодолее този механизъм резистентност специфични инхибитори на бета-лактамаза са синтезирани, които могат да инхибират активността на широка гама от бета-laktmaz произведен от Грам-положителни и Грам-отрицателни анаеробни патогени. В тази статия ще обсъдим механизма на действие и спектър на действие на един от най-често се използва бета-лактами ingibitorozaschischennyh - амоксицилин / клавуланат.
Семейството на бета-лактамни антибиотици включват четири основни групи антимикробни: пеницилини, цефалоспорини, карбапенеми и монобактами.
Бета-лактамни антибиотици действат върху бактериалната клетка в два основни начина. Първо, те са вградени в стената на бактериалната клетка и инхибира транспептидаза активността на ензима участват в крайния етап на строителство на бактерии стени. На второ място, те се свързват към свързване пеницилин протеини (РВР), които обикновено инхибират хидролаза бактериалните клетки и по този начин освобождават хидролаза, което води до лизис на бактериалната стена. За борба с тези основни механизми на действие на бета-лактами бактерии придобили способността да произвежда специални ензими бета-лактамази, които могат да хидролизират бета-лактамния пръстен и промените вида на структурата на PSB [1].
Синтез на бета-лактамаза, кодиран от или хромозоми (конститутивна тип) като Pseudomonas Aeruginosa, или плазмиди (индуцируем тип) като Aeromonas hydrophila, и стафилококус ауреус. Плазмиди могат да се прехвърлят от една бактерия в друга, което допринася за бързото разпространение на резистентност.
Механизмът на действие на бета-лактамази
Бета-лактамазни ензими разрушават бета-лактамния пръстен от два основни механизми. Първият механизъм присъщи лактамази от клас А, С и D (разделянето на класове се извършва в съответствие с последователността на аминокиселини в структурата на ензим), се свързва към основата, поради наличието на специален гъвкав активното място (фиг. 1). Необратимо свързване на карбонилна група с въглероден бета-лактамния пръстен и нарушаване на целостта си, което прави антибиотик неактивно състояние и едновременно осигурява регенериране на бета-лактамаза. Тези класове на бета-лактамази активни срещу много от пеницилини, цефалоспорини и монобактами. Вторият механизъм е присъща в по-общ група на бета-лактамази, които принадлежат към клас Б. Ензимите от този клас се наричат метало-бета-лактамази, тъй като те съдържат подвижен двувалентен метален йон, най-често е цинков йон, който е способен на свързване към карбонилната група на повечето пеницилини, цефалоспорини и карбапенеми, но не монобактами [1].
Класификация на бета-лактамаза
От 60-те XX век предложи няколко класификации на бета-лактамаза, въз основа на техните биохимични и функционални характеристики и различия в молекулната структура (раздел. 1) [3-5].
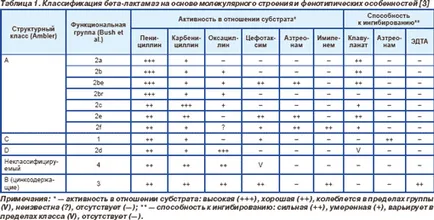
Най клинично значими бета-лактамази принадлежат към класове А и В. По-специално, клас А включва хромозомна бета-лактамаза Klebsiella SPP., Citrobacter diversus. Протей вулгарис и най Bacteroides SPP. както и почти цялото плазмид бета-лактамаза. Клас C съдържа цефалоспориназна хромозомни ампера, клас В - окса ензими, които са широко разпространени в плазмиди ентеробактериите. Клас В съдържа, както е споменато по-горе, някои бета-лактамаза като цинков йон [3].
Хромозомни бета-лактамази, присъстващи в бактерии първоначално, преди развитието на антибиотици (AB): те са включени в метаболизма на микробни клетки, както и защита на бактериите от бета-лактамаза, произведен от гъбички в естествени среди. Понастоящем обаче основният фактор щамове избор - производители бета-лактамаза е да се използва бета-лактам AB които насърчават бактериални изкуствени избор в следните области: 1) производството на големи количества от бета-лактамаза; 2) наличието на допълнителен бета-лактамаза, кодиран от плазмидите; 3) мутация на съществуващите бета-лактамаза с разширяването на техния спектър на действие. Такова изкуствен избор предпочитан избор на цели отделни видове или щамове на бактерии - производители на бета-лактамаза, характеризиращ се с процеса на селекция с генерирането на нови бета-лактамази настъпили успоредно на развитието на нови антибактериални лекарства, чиято цел е наличието на устойчивост на бета-лактамази. Преодоляването на този механизъм устойчивост на бактериите се извършва по два начина: химическа модификация на комбинация от антибиотици и бета-лактами с инхибитори на бета-лактамаза.
Първият възбудител да са придобили способност да произвеждат бета-лактамаза, Staphylococcus стомана: ако през 1944 бензилпеницилин е активен срещу 95% от щамове на Staphylococcus Aureus. само 5% от изолатите разработени бета-лактамаза и са резистентни към него, след това след 5 години, делът на бета-лактамаза щамове увеличи до 50%, и след години - до 90% поради генен трансфер и селекция на резистентни щамове. Създаване на 60-те години на XX век, метицилин и резистентни стафилококови Оксацилин бета-лактамази и все още запазва своята клинична ефикасност срещу метицилин щамове, е пример за подход, насочен към химична модификация на AB [6].
Впоследствие проблеми AB съпротивление, причинено от производството на бета-лактамаза влияе до голяма степен грам-отрицателни пръти, което се дължи до голяма степен за развитието на нови AB (таблица. 2) [3]. Някои Грам-отрицателни бактерии имат естествена устойчивост на производството на бета-лактам поради голям брой хромозомни бета-лактамази: Klebsiella SPP. аминопеницилините резистентни (ампицилин, амоксицилин) и karboksipenitsillinam (карбеницилин и тикарцилин). Въпреки това, с въвеждането на AB бета-лактам, активен срещу грам-отрицателни флора клинична стойност, получена микроорганизми, придобили резистентност поради синтез на индуцируеми бета-лактамази от клас А (P.vulgaris, C.diversus) и индуцируем бета-лактамаза AmpC (Enterobacter SPP . Citrobacter freundii. Morganella morganii. Providencia SPP. Serratia SPP. Pseudomonas Aeruginosa), който предвижда тях устойчиви на аминопеницилините и цефалоспорини I поколение. Най клинично важно следствие от използването на бета-лактам, активен срещу грам-отрицателни флора, е разпространението на плазмид бета-лактамаза ТЕМ-1 предимно между видовете първоначално чувствителни към този AB. В момента 60% от щамове на Enterobacteriaceae произвеждат този тип бета-лактамаза, чиято честота надвишава честотата на всички други видове (2-TEM, SHV-1, окса-1) е повече от 10 пъти. От средата на 70-те години на бета-лактамаза ТЕМ-1 разпространи и в други грам-отрицателни бактерии, Pseudomonas и Vibrio холерният. Този тип ензим е единственият представител на плазмид бета-лактамаза от Neisseria гонорея, показва в 1-40% от щамовете. Същият ензим, произвеждан 2-40% Haemophilus грип щамове в зависимост от географската област и капсулен вида и неговата честота над друг тип бета-лактамаза на микроорганизма (ROB-1) 10 пъти. И само Pseudomonas и Moraxella catarrhalis ТЕМ-1 губи първенството, като начин да си PSE-1 и PSE-4 от Pseudomonas и BRO-1, BRO-2 при M.satarrhalis. В момента, над 80% от щамовете M.satarrhalis произвеждат бета-лактамаза. Всички тези бета-лактамаза (ТЕМ-1, ТЕМ-2, SHV-1, PSE-1, PSE-4, BRO-1, BRO-2) принадлежат към клас А, предоставяне на подобно ниво на устойчивост на амино, карбокси, уреидо и piperazinpenitsillinam и поколение цефалоспорини I [7].
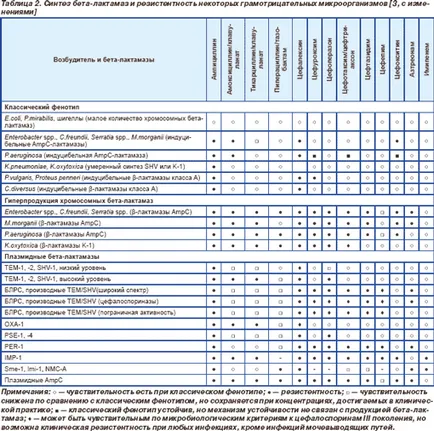
След създаването на ново поколение се появи в Enterobacte R SPP цефалосфорин резистентност към тях. C.freundii. Serratia SPP. M.morganii. P.aeruginosa поради увеличаване на синтеза (свръхпроизводство) на бета-лактамаза AmpC, където честотата на тези щамове в някои европейски страни, до 70%. По-късно този ензим се открива в E.coli и Klebsiella SPP.
В средата на 80-те години XX век бета-лактамаза с разширен спектър са идентифицирани (ESBL), повечето от които се появяват поради ТЕМ-1 мутации тип ензим, ТЕМ-2, SHV-1. Най-често тези бета-лактамази са открити в Klebsiella SPP. [8].
Карбапенеми имат най-високата сред всички бета-лактам резистентни към всички бета-лактамаза плазмид на класове А, С и D. Обаче, понастоящем има генериране на нови бета-лактамази, предимно от класа, способността да се инактивира карбапенеми. Сред тях са най-важните ензими, произведени от Stenotrophomonas малцорШИа. карбапенеми и широко използване могат да допринесат за по-нататъшно избор на този щам. страхове, също води до поява на Enterobacteriaceae. P.aeruginisa, Serratia marcescens, K.rneumoniae плазмид ензим клас Б (IMP-1), който осигурява резистентност към всички бета-лактамни антибиотици, освен монобактами [9].
Най-ефективната стратегия, насочена към преодоляване на специфични механизми на резистентност, дължащи се на производството на бета-лактамаза, за момента е да се използва ingibitorozaschischennyh бета-лактамни антибиотици. Тяхната широк спектър на действие се дължи на способността да инактивира широк спектър от инхибитори на бета-лактамазите, продуцирани от грам-положителни, грам отрицателни и анаеробни организми.
И въпреки, че те не са надеждно средство за бета-лактамази от широкоспектърни цефалоспорини, вместо използването им намалява избора на производителите на този вид бета-лактамаза.
Бета-лактамазни инхибитори са бета-лактам структура, която необратимо свързва с ензимите се докато бъдат унищожени, като по този начин те се наричат инхибитори самоубийство. В момента клинично значение има три такива инхибитори: клавуланова киселина (клавуланова киселина) и две производни на пеницилановата киселина - сулбактам и тазобактам.
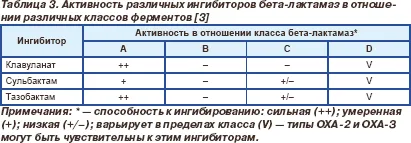
Всички инхибитори на бета-лактамази инактивират повечето от бета-лактамази от клас А, особено хромозомни ензими Bacteroides SPP. C.diversus, Klebsiella SPP. P.vulgaris. стафилококова пеницилиназа и бета-лактамази ТЕМ и SHV -. класически и разширен спектър (Таблица 3) [3]. Въпреки това, активността на клавуланат тазобактам срещу ТЕМ ензими е почти 10 пъти по-голяма от активността на сулбактам. Клавуланат и пенициланова киселинни производни са активни срещу някои бета-лактамази от клас D, активност срещу клас С имат ниска или отсъства.
Клавуланат е първата бета-лактамазен инхибитор, получен клинична употреба. Той е високо активен срещу бета-лактамази от клас А, особено хромозомни бета-лактамази от Bacteroides SPP. C.diversus, Klebsiella SPP. P.vulgaris. P.mirabilis, Moraxella catarrharalis, стафилококови пеницилази, както и бета-лактамаза TEM и SHV, които често са произведени от членове на семейството Enterobacteriaceae. Haemophilus инфлуенца. Neisseria гонорея. Въпреки че е стабилен растеж поради производство на бета-лактамаза, повечето клинично значими бета-лактамази запазва неговата чувствителност към клавуланат (таблица. 2) [3].
Клавуланат също проявява своя антибактериална активност срещу Грам-положителни и Грам-отрицателни бактерии и анаероби, механизмът на тази дейност не е свързан с инхибирането на бета-лактамаза (раздел. 4) [10]. Клавуланат показва най-ниската активност срещу Pseudomonas aeruinosa и ентерококи по-изразен - по отношение на Enterobacteriaceae и Н. influenzae, най - срещу Bacteroides Fragilis и други анаероби, M.catarrhalis. стафилококи и стрептококи. Клавуланат е също активен срещу Neisseria SPP. и проявява добра активност срещу атипични бактерии като Chlamydia SPP. и Legionella SPP. [10].
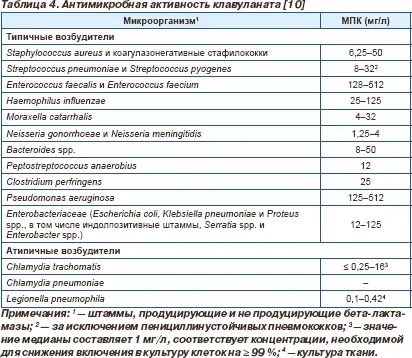
клавуланат активност се изследва в комбинация с други антимикробни средства, включително пеницилин и тикарцилин, но като амоксицилин / клавуланат е най-често използваната комбинация, повечето проучвания са изследвали активността на клавуланат се комбинира с амоксицилин.
От клинична гледна точка, интерес е antipnevmokokkovaya дейност на амоксицилин / клавуланат, както се наблюдава в някои региони, ръстът на Staphylococcus пневмония резистентност е основна грижа. Ин витро проучвания показват, че клавулановата киселина може да се увеличи antipnevomokokkovuyu активност на бета-лактамни антибиотици, поради допълнително свързване на PSB. Например, добавянето на клавуланат намалява минималната инхибираща концентрация (MIC) на пеницилин до 1/3 и penitsillinustoychivye пневмококови щамове в присъствието на промяна на форма и обем на микробни клетки. По този начин, допълнителен свързващ DPM прикрепен амоксицилин / клавуланат по-ясно изразено в сравнение с амоксицилин antipnevmokokkovuyu активност [10].
Клавуланат също има висока активност ин витро срещу Legionella pneumophila. където синергизъм между klavaulanatom и амоксицилин срещу този патоген е причинена не толкова бета-лактамаза клавуланат активност (Legionella произвежда бета-лактамаза с ниска активност), но допълнително свързване на клавуланат и амоксицилин с DPM. С по-ясно изразено в сравнение с пеницилини способността да проникват в клетките много по-ефективно клавуланат амоксицилин актове вътреклетъчно разположени на Legionella pneumophila [10].
Клавуланат също има способността да значително с 70-80%, намаляване на вътреклетъчния басейн на Chlamydia трахоматис. Клавуланат активност срещу атипични патогени, определени ин витро. и беше потвърдено ин виво в експериментални модели на пневмония при мишки, причинени от Chlamydia трахоматис и Legionella pneumophila, където Legionella пневмония активност на амоксицилин / клавуланат е сравнима с тази на еритромицин и доксициклин.
Налице е също доказателство за по-висока активност амоксицилин / клавуланат в сравнение с амоксицилин срещу периодонтални щамове флора (Actinobacillus actinomycetemcomitans и Enterococcus фекалии) и E.coli. не произвеждат бета-лактамази.
Клиничната ефикасност на антибиотик зависи не само от действителното антимикробни свойства на препарата, но също и от неговото взаимодействие с факторите на имунната защита на микроорганизъм. Резултатите от ин витро изследвания са показали подобрение на защитните свойства на гостоприемник чрез подобряване на микробни улавяне полиморфонуклеарни клетки и последващото разрушаване на патогена, както и подобрени хемотаксиса и адхезията на полиморфонуклеарни клетки. Положителното влияние на амоксицилин / клавуланат микроорганизъм на имунния отговор може да има положителен ефект върху клиничния резултат на пневмококови инфекции, в която полиморфонуклеарни клетки са на първа линия на защита [10].
Клавуланат положителна черта е независимостта на неговата ефективност от рН на околната среда. В допълнение, амоксицилин / клавуланат (АМО / R) съчетава свойствата на инхибитор на бета-лактамаза, добра бионаличност и широк спектър на антимикробна активност на амоксицилин, което го прави далеч само представителни ingibitorozaschischennyh пеницилини, подходящи за перорална терапия. Наличие на форми за парентерално приложение че най-добрият лекарството на всички ingibitorzaschischennyh пеницилини за последователно терапия прави.
5. Richmond М.Н. Сайкс R.B. Р-лактамази от грам-отрицателни бактерии и тяхното възможно физиологичната роля // напредък в Microbial Physiology. - 1973-9 - 31-88.
6. Лейси R.W. Резистентността към антибиотици в стафилококус ауреус и стрептококи // British Medical Bulletin. - 1984-40 - 77-83.
7. Ливърмор D.M. Имате бета-лактамаза капан цефалоспорини? // вестник на антимикробна химиотерапия. - 1985 г. - 15. - 511-4.