Твърди и меки киселини и основи
Понятия на твърди и меки киселини и основи, RJ Pearson
В момента се използва концепцията, предложена от Pearson, че всички киселини и основи могат да бъдат разделени в два класа - меки и твърди. За тях вярно правило: меки киселини се свързват с меки основи, трудно киселина - твърда основа.
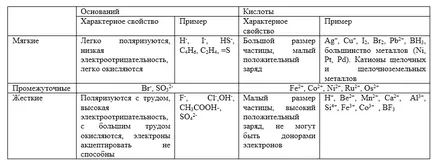
Меки киселини са големи и малки положителен заряд ($ Cu ^ + $, $ Ag ^ + $, $ Au ^ + $, $ ^ Hg + $, $ Pt ^ $, $ Br_2 $, $ I_2 $ и др.) ,
Твърд киселина характеризира с малък размер и голям положителен заряд ($ H ^ + $, $ Мп ^ $, $ Fe ^ $, $ CO ^ $ и др.). Те могат да действат само като електронни акцептори.
Меки основи са силни редуциращи агенти ($ H ^ - $, $ I ^ -. $, $ S ^ $, $ CO $, $ R_2S $ и др).
Твърди основи са силни окислители ($ F ^ - $, $ Cl ^ - $, $ ОН ^ - $, $ NH_3 $, $ H_2O $ и др.).
За междинните киселини са двойно $ г $ - йони ($ Fe ^ $, $ CO ^ $, $ Ni ^ $ и др.) И Междинно съединение основи ($ Вг ^ -. $, $ SO_3 ^ $ и др).
Отличителни свойства на твърди и меки киселини и основи
Концепцията на твърда и мека, не са идентични понятия за силен и слаб.
И примери за най-важните характеристики на твърди и меки киселини и основи са изброени в таблица
От гледна точка на твърди и меки киселини теории разглеждат следните реакции:
Реакции, свързани с електронен трансфер
$ H_3O ^ + + NH_3> H_2O + NH ^ $
Реакционната Като допълнение за получаване на съединения (реакцията между киселината и базата в общ вид .:
Нуклеофилно заместване. Particle - нуклеофил (анион или молекула) $ Б: `$ носи свободна двойка електрони, поради което нова връзка. $ AB $ молекула претърпява нуклеофилна атака, $: B $ е отцепваща се група.
Електрофилно заместване. Електрофилно агент А, е непълна електронен слой и се стреми да ги запълни. Молекула $ BA $ преживява една атака на Електрофилът.
Съобщение остри киселини с твърда основа се дължи на йонна сила. Soft свързват база мек киселина чрез ковалентни връзки. За ковалентна връзка е достатъчно силна, е необходимо, че атомите са подобни по размер и електроотрицателност стойности.
Той се използва широко за практически цели:
Това обяснява защо в природата се среща като алуминиев оксид, хидроксид и силикат, мед, живак - като сулфиди, калций - като карбонат. Метали на прехода група VIII елементи като меки киселини катализират реакции, които включват слаба основа (въглероден окис). Мека база (съединението от арсен и фосфор) са каталитични отрови, защото те могат да образуват стабилни съединения с тези метали и блокира техните активни центрове.
Това обяснява токсичността на въглероден окис при хора. Въглероден диоксид образува по-стабилно съединение от кислород хемоглобин с железен желязо.
По същия начин, въглероден окис са йони на тежки метали ($ Pb ^, Hg ^ $), които взаимодействат с $ SH $ - физиологично важни групи от съединения могат да блокират тяхната функция.