Структура и принцип на работа на електрохимичната клетка - studopediya
Метални потапя в електролитен разтвор, наречен електрод. Електроди - система от две проводящи тела - проводниците на първи и втори род. По първия вид проводници включват метали, сплави, проводими метални оксиди, както и неметални материали като графит; зареждате носители - електрони. Към проводници от втория вид са електролитни разтвори и се топи; зареждане носители - йони. Устройство, състояща се от два електрода, наречен електрохимична клетка.
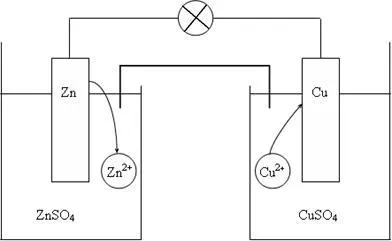
Фиг. 2. Схемата на мед-цинков галванична клетка
Да разгледаме галваничен елемент Jacobi-Daniel (схема, показана на фиг. 2). Състои се от цинк плоча, потопен в разтвор на цинков сулфат и медна плоча, потопен в разтвор на меден сулфат. За да се предотврати директно взаимодействие между електродите окислителя и редуктор разделени от пореста преграда.
В галванична клетка електрода направен от по-активен метал, т.е. от метал, който се намира от лявата страна в електрохимична сериал, наречен анод. и електрод е направен от метал, по-малко активни - катод.
На повърхността на цинков електрод (анод) електрически двоен слой, и е установено равновесие:
В резултат на този процес протича електрод потенциал на цинк.
На повърхността на медната електрод (катод) като електрически двоен слой, и е установено равновесие:
Резултатът е потенциал меден електрод.
Тъй като потенциалът на цинков електрод има по-отрицателна стойност от потенциала на мед електрод, след това чрез затваряне на външната верига, т.е. съединение с цинк метална мед проводник, електроните ще се движат от цинк на мед. В този процес, равновесието на цинков електрод се измества надясно, така че разтворът влиза допълнителни цинкови йони. В същото време, балансът в медната електрод ще се измести наляво и освобождаване на медни йони.
По този начин, чрез затваряне на външната верига настъпи спонтанен процес на разтваряне на цинка в цинков електрод и извличане на мед в медния електрод. Тези процеси ще продължи толкова дълго, колкото възможностите са подравнени или не да се разтворят всички цинк или мед земя електрод на всички медта.
Така че, когато се използва клетъчна Якоби Daniel появят следните процеси:
1. анода процес, процес на окисление:
Zn 0 - 2, # 275; → Zn2 +.
2. Процесът на катод, процесът на възстановяване:
Cu 2+ + 2 # 275; → Cu 0.
3. движението на електрони във външната верига.
4. Движението на йони в разтвор: SO4 2- аниони на анода, Си2 + катиони към катода. Движението на йони в разтвор завършва електрическата верига на електрохимичната клетка.
Обобщавайки реакцията на електрод, получаваме:
Zn + Cu 2+ = Zn 2+ + Cu.
В резултат на потока на реакцията се осъществява в клетка движение на електроните в външна верига и йони вътре в елемента, т.е. електрически ток. Следователно, общата химична реакция, протичаща в клетката, наречен ток образуващ реакция.
Електрическият ток в клетката се дължи на реакцията на редокси срещащи се, така че процесите на окисляване и редукция са пространствено разделени: отрицателния електрод (анод) протича процес на окисление на положителния електрод (катод) - процеса на възстановяване.
Необходимо условие за работа на електрохимичната клетка е потенциална разлика между електродите. Максимална електрод потенциална разлика, която може да бъде получена по време на работа на електрохимичната клетка, наречена електродвижеща сила (EMF) на елемента. Тя е равна на разликата между катодния потенциал и потенциала анод на елемента:
EMF елемент се счита за положителна, ако текущата реакция, в тази посока настъпва спонтанно. Положителен едн съответства на определен ред и в схеми запис единица: лява записва електрод трябва да бъде отрицателен. Например, елемент-Якоби Даниел схема се изписва така: