Сол и кристализация на натриев сулфат
Заедно с натриев хлорид съществуват голям брой други соли, които могат да бъдат обект на интерес опит. Обърнете сярна киселина, която е не-притежаващ ниска химична сила от натриев хидроксид, една капка му спадна на ръка, про-олово причинява остра болка и тежки изгаряния; парче дърво, ако тя се потапя в тази киселина, почти веднага овъглени.
Ако смес от сярна киселина от 49 до 30 части от натриев хидроксид, ще проходен изключително силна реакция, придружаваща Xia значително увеличение на температурата. След охлаждане на сместа, получена вещество, което може да отнеме без никаква вреда: киселина се свързва с каустик алкален и тяхното взаимно ЛИЗАЦИЯ консумира. От тях, полу-chilas сол, известен под името, лого sernokis хидроксид (натриев сулфат). Това-е, не оказва никакво влияние върху лакмусова хартия и има никакво отношение към тази субстанция-ми, от които се оказа.
химията на сол - съединение yuschiesya-при което се получават в резултат на реакцията между сладко-играчката и алкален или основа. Соли демон-числен комплект. Някои от тях, като меден оксид сулфат, калиеви hromovokis-Ly - притежават характерен цвят Coy; други, като например натриев сулфат, - безцветен.
Последният от тези вещества, като болка вратовете на порциите соли могат да получат кристално кристално форма: ако тя се разтваря в заври-ке и разтворът се оставя в покой, а след това скоро ще започне да се образува прозрачна, много красива призма. Това вещество глауберова открито и че понякога се нарича сол-вой глауберова.
Натриев сулфат принадлежи на соли са силно разтворими във вода. Най-добър натриев сулфат се разтваря при температура от 32,4 ° С, с увеличаване и намаляване темпера-тура го намалява. Ако се изсипва ла слой тегло на повърхността на наситен разтвор на SFA-uberovoy сол, след това, докато течността е в покой, не настъпва образуване на кристали в него; но трябва да се потапя в раса-става стъклена пръчка и кристализацията започва веднага (фиг. 116).
Фиг. 116. Съдът, съдържащ свръхнаситен разтвор на натриев сулфат, кристализация от които е показано на дясната част на фигурата.
Тази интересна явление става още по-ясно, ако топло концентриран разтвор се поставя в тънка стъклена тръба и AB-ку спойка последния алкохол лами NE след нея чрез кипене изключен въздух (фиг. 117).
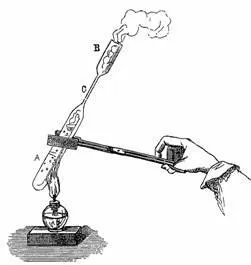
Фиг. 117. Получаването на свръхнаситен разтвор на натриев сулфат.
По този начин запечатана епруветка разтвор сулфат хидроксид дава кристали дори при 0 °, nesmot метох че охладена течност тучни-ditsya количество сол е десет пъти по-голяма от тази, която може да бъде разтворено в него при тази температура. Но е необходимо само да се прекъсне от края на тръбата, и кристализация се случва веднага.