решетки
Веществото, както знаете, може да съществува в три състояния: газ, течно и твърдо. Например кислород. които при нормални условия е газ при температура от -194 ° С в течна превръща синьо, I при температура -218,8º С в сняг втвърдява маса, която се състои от сини кристали.
В този раздел ще разгледаме как функции влияят върху химическите връзки за свойствата на твърди частици. температурен интервал на съществуване на вещества в твърдо състояние се определя от неговите топене и кипене точки. Твърдите частици попадат в кристална и аморфна.
Аморфни вещества не разполагат с ясна температура на топене - при нагряване те постепенно омекна и се прехвърлят в течен състояние. В аморфно състояние, например, е глина или различни смоли.
Кристални материали се характеризират с редовен режим на частиците от които те се състоят: атоми, молекули и йони. - в строго определени точки в пространството. Чрез свързването на тези точки с прави линии образува пространствена конструкция, която се нарича решетка. Точките на която частицата има кристална решетка, наречена изложени.
Възлите могат да бъдат измислени решетъчни йони, атоми и молекули. Тези частици осцилира. С повишаване на температурата в обхвата на тези вибрации се увеличава, което обикновено води до топлинно разширение на телата.
В зависимост от вида на частиците разположен в кристалната решетка, както и естеството на връзката между тях четири вида кристални решетки: йонни, атомна, молекулна и метал (Таблица 6).
Обикновено вещества други елементи, които не са изброени в Таблица 6 са металната решетка.
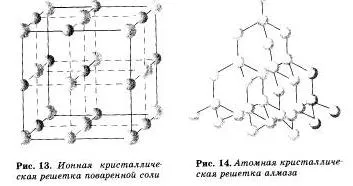
Наречен йонни решетки, в който йоните са възли. Тези вещества образуват йонна връзка, който може да бъде свързан както прости йони Na +, Cl- и SO 2- 4 комплекс, OH. Следователно, йонни соли са кристалната решетка, някои метални оксиди и хидроксиди. т.е. тези вещества, когато има йонна химична връзка. Например, кристалът на натриев хлорид е изграден от редуващи положителни йони на Na + и СГ отрицателен, формиращи металната решетка с форма на куб. Комуникацията между йоните в кристал е много стабилна. Така, средства с йон reshetnoj имат относително висока твърдост и устойчивост, те са огнеупорни и нелетливи.
Излива атомна кристална решетка, във възлите, които са отделни атоми. В такива решетки атомите свързани помежду си чрез много силни ковалентни връзки. Примери за вещества с този тип на кристални решетки могат да бъдат диамант - една от модификациите на въглероден алотропна.

Броят на вещества с атомна решетка не е много голяма. Те включват кристален бор, силиций и германий, и комплексни вещества, например тези, които включват силициев оксид (IV) - SlO2: силициев двуокис, кварц, пясък, кварц.
Повечето съединения с атомни кристалната решетка имат много високи точки на топене (например, диамант е над 3500 ° С), те са силни и трудно, почти неразтворими.
Наречен молекулни решетки, които са разположени на възлите на молекулата. химичната връзка в тези молекули може да бъде полярен и неполярен. Въпреки факта, че атомите в молекули са свързани чрез ковалентни връзки са много силни. между молекулите в себе си са слаби сили mozhmolekulyarno първата атракция. Така, средства, с молекулни решетки имат ниска твърдост, с ниска точка на топене, летливи.
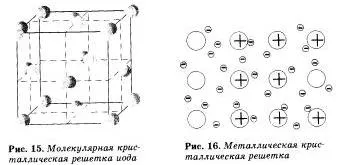
Примери за вещества с молекулни решетки са твърди вода - лед, твърд въглероден оксид (IV) - «сух лед", твърди сероводород и хлороводород, прости твърди вещества, образувани от едно- (благородни газове), два пъти. три (О3), четири (P4). vosmiatomnymi молекули. Повечето твърди органични съединения имат молекулни решетки (нафталин, глюкоза, захар).
Вещества с метална връзка имат метална кристална решетка. Възлите на такива решетки са атоми и йони (атома, че йоните са лесно превърнати в метални атоми, давайки техните външни електрони в обща употреба). Такива метали вътрешна структура, която определя техните характерни физични свойства: ковкост, пластичност, електрическа и топлинна проводимост, характерен метален блясък.
За вещества с молекулна структура, само отворите френски химик JL Пруст (1799-1803) правото на постоянен състав. Понастоящем това право е формулиран, както следва: "Молекулните химични съединения, независимо от техния метод за получаване имат постоянен състав и свойства. право на Пруст е един от основните закони на химията. Въпреки това, за вещества с nsmolekulyarnym структура, като например йони, този закон не винаги е справедлив.
1. твърдо, течно и газообразно състояние на материята.
2. на твърдо вещество: аморфна и кристална.
3. кристалната решетка: атомно, йонни и молекулно метал.
4. Правото на определени пропорции.
Какви са качествата на нафталин са основа на заявлението си за защита на вълнени дрехи от молци?
Какви са характеристиките на аморфни твърди вещества са полезни за opnsaiiya черти на характера на физическите лица?
Защо отворен К. Х. алуминий датски учен Оерстед през 1825 година за дълго време бе за благородните метали?
Мисли на продукт А. Belyaeva "въздух продавача" и описват свойствата на твърдо вещество кислород, с помощта на описанието, дадено в книгата.
Защо температура на топене на метал варира в много широки граници? За подготовката на отговора на този въпрос, използвайте допълнителна литература.
Защо е продукт на силиций в момента на удара се раздели на парчета, а продукт на преднина повален само? В някои от тези случаи е унищожаването на химичната връзка, и в която - не? Защо?
Ако имате корекции или предложения на този урок, моля свържете се с нас.
Ако искате да видите и другите корекции и предложения за уроци, погледнете тук - Образователен форум.