работа 2
6. ли е възможно взаимодействие между оксиди: Li 2О и SO 3; Na 2О и ВеО; Al 2O 3 и К 2О; BaO и MgO; N 2 O 5 и ZnO? Дайте мотивиран отговор и донесе равенството на съответните реакции.
7. Какво свойства хидроксиди NaOH, Al (OH) 3. Ni (ОН) 2 може да се използва за отделянето им от твърдата смес?
Цел - асимилация еквивалентни понятия моларни методи еквивалентно тегло изчисление моларни еквивалента масови вещества; експериментално определяне на неизвестен метал метод еквивалент обемен.
Количествени оценки химия въз основа на закона за запазване на масата (Ломоносов, 1756, Лавоазие, 1785): маса, равна на масата на реагентите на реакционните продукти. За да се определи размера на реакционните продукти, образувани когато известно количество реагенти необходимо да се създаде пълно взаимодействие с коефициенти уравнение.
Германски химици Wenzel и Рихтер формулирани еквивалента право (1793): вещества реагират и форма в еквивалентни количества, което позволява изчисляване без да прави пълен уравнение на реакцията.
На единица еквивалент приет един мол от водородни атоми, моларната маса на която е равна на 1 г / мол (по-точно, 1.00794 грама / мол). ЕКВИВАЛЕНТИ други вещества, определени количество от веществото, което е в химични реакции е еквивалентна (или свързва заменени) 1 мол от водородни атоми или един електрон в реакциите на оксидативния намаляване.
Броят показва какъв процент от мола вещество еквивалентно на един атом в реакцията на водород или един електрон се нарича еквивалентност фактор е.
Фактор еквивалентност равностойност обратен номер Z, която е числено равно на абсолютната стойност на степента на окисление
йон или броя на електроните прехвърлени редуктор или окислител от окислител приет редуктор: F = 1 / Z.
молекулна маса М екв еквивалент на Z пъти по-малки от съответните моларни маси M вещества, участващи в реакцията:
Еквивалентно вещество не е постоянна, тя се изчислява за всяка реакция, при която се натоварват с това вещество.
Примери за изчисления.
1. Определяне на моларните маси и еквивалентността еквиваленти вещества, участващи в обменни реакции:
а) броя на еквивалентност определя от размера на водородни йони киселина се заменят с метални йони, т.е.. д.
+ NaOH → NaH 2 PO 4
+ Н 2О; Z к = 1; М = ekv.k
Н 3РО 4 + 2NaOH → Na 2НРО 4
+ 2Н 2О; Z к = 2; М = ekv.k
+ 3NaOH → Na 3РО 4 + 2 3H О; Z к = 3; М = ekv.k
б) за база броя определя от размера еквивалентността на хидроксидни йони, които са заместени с киселинни аниони, т.е. киселинност база ..:
+ HCl → Al (OH) 2 Cl + Н 2О; Z est = 1; М = ekv.osn
Al (ОН) 3 + 2HCl → Al (OH) Cl2 + 2Н 2О; Z = OCH 2; Ekv.osn М = М ≈ 39 гр / мол;
Al (ОН) 3 + 3HCl → Al (ОН) 3 + 2 3H О; Z = ОСН3; Ekv.osn М = М ≈ 26 грама / мол;
в) броят на еквивалентност на продукта сол се определя от степента на окисление на катиона (или анион модул) п броя на йони m, Z = нм:
NaCl: Z = 1 · 1 = 1; М = М екв ≈ 58,5 г / мол
Na 2 SO 4. Z = 1 х 2 = 2; М екв = 1 / 2М ≈ 71,0 г / мол
Al 2 (SO 4) 3. Z = 3 х 2 = 6; Eq = 1 М / 6М ≈ 192 грама / мол
2. Определяне на броя на еквивалентност и молната маса еквивалента на окислителя и редуктор в редокс реакции.
Броят на еквивалентност на окислителя и редуктор в реакцията на окисление-редукция, определена от броя на електроните прието или отливка.
2KMnO 4 + 5K 2 SO 3 + 3H 2 SO 4 → 2MnSO 4 + 6К 2 SO 4 + Н 2О
SO 3 2- - 2е + H 2 O → SO 2 Април - + 2Н + Z = 2;
Експериментално еквивалент на прост вещество може да се определя от броя на заместими водород или свързан кислород, или друг елемент, еквивалентна на който е известен. Еквивалентно може да се определи от електрохимични средства на базата на закона на Фарадей, според който преминаването на заряд 96484 Cl чрез електролитния разтвор на електродите става един еквивалент вещество.
В този документ, метод за определяне на активен метален еквивалент, въз основа на измерване на обема на водород освободен по време на метал разтваряне в солна киселина:
Ме + nHCl → метиленхлорид п + п / 2Н 2
Според еквиваленти право, един еквивалент от метал измества един водороден еквивалент, с молекулна маса еквивалентна на 1 г / мол.
Използване на закона на Авогадро, можем да дефинираме обем, който се един мол еквивалента водород при определени физически условия. При нормални физически условия (STP,
р = 1.013 х 10 5 Ра и р = 760 мм живачен стълб. Чл. Т = 273 К) 1 мол водород с тегло от 2 г / мол, заема обем V = 22,4 литра, след това 1 мол еквивалента на водород с тегло 1 гр / мол, трябва да заемат обем V екв H 2 = 11.2 литра ,
По този начин е възможно да се изчисли обемът заета от един еквивалент на всеки газ. Например, за еквивалентно количество от О 2 равно на V екв Н 2 = 5.6 литра (STP), като моларни еквивалента масови
че кислородът е на 8 г / мол, и е 1/4 от моларното количество; на хлороводород 1 мол еквивалента заема обем V екв HCl = 22,4 литра (STP), като моларен еквивалент тегло равна на неговата молекулна маса (Z = 1).
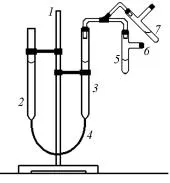
Моларен еквивалент тегло на метал се определя чрез инструмент, наречен евдиометър (фиг. 2.1). Устройство 1 включва статив, на която са фиксирани бюрета 2 и 3 свързан маркуч 4. бюрета с напречно сечение от 1 cm 2 и калибриран с точност до 0.1 cm, нулевата точка е в горния
Тя е част от стъкленицата.
Към бюрета 3 е свързан с освобождаване тръба 5 тръба 6. бюрета напълнената с вода, тръбата 5 - концентрирана солна киселина. тръбата на изхода се поставя металната проба с известна маса. След зареждане на метала, инструментът се проверява за течове, увеличаване или намаляване на byu-
Фиг. 2.1. Евдиометър Roethke 2 относителна бюрета 3, където нивото на водата в този случай ще варира, но не са склонни да се изравнят с нивото на
бюрета устройство 2. След проверка за течове в нивото на водата се изравнят позиция в двете бюрети и маркира позицията на нивото в бюрета 3 по-ниски менискуса, записване на стойност на скалата на калибриране в рамките на 1 час 0.1 cm.
След това внимателно се изхвърля метал в киселина, превода тръба 5 от позиция 6 в позиция 7. В процеса на разтваряне на метал бюрета 2 се понижава, така че нивото на водата в бюрета не е твърде различно. В края на процеса на метал разтваряне в киселина нива точно съответствие позиция в двете бюрети и записва ниво нова позиция з 2 в бюрета 3.
Обемът на водород еволюира в реакцията, V е ниво разлика V на = Н 2 - з 1. измерва в кубични сантиметра (милилитра) при атмосферни условия (р, Т) на експеримента.
В съответствие с правото на E мет еквиваленти метал еквивалент. с молекулна маса М екв. измества вода еквивалент
N. Е вид, който при нормални условия, заема обем V = екв = 11 и 200 cm 3, използван в експеримент метал тегло М измества обем водород V на 0. редуцира до нормални условия:
Изчисляване на моларната маса на метални еквивалента на уравнение (2.3) може да бъде определена чрез избиране на металните стойности на моларен неговата маса М = М ekv.eksp Z, като се посочва, например, три последователни стойности Z, равно на 1, 2 и 3.
Периодичната система на елементите DI Менделеев изберете метал проявяващи валентност съответния Z, за които несъответствието изчислява моларни маси маса по-малко от 1 ... 2 г / мол. След това ние очакваме да изпитат относителна грешка от уравнението
М = М ekv.tabl - М ekv.eksp 100%
ekv.eksp където М - метален еквивалент моларна маса, изчислена от експерименталните данни съгласно уравнение (2.5); М ekv.tabl - теоретична молна маса от метален еквивалент, изчислена съгласно уравнението
М = М Таблица ekv.tabl / Z.
Получените резултати в таблица правят. 2.2.
Въпроси за приготвяне лаборатория отбраната
1. Моля, отбележете съединения моларно еквивалентно тегло е половината от моларната маса: CO 2. Са (ОН) 2. Na 2НРО 4. KHS, К 2 Сг 2О 7. К 2 СгОз 4.
2. Изчисляване на моларен еквивалент тегло от следните редуциращи агенти: а) калаен хлорид (II) оксидиране на калаен хлорид (IV); б) елементен фосфор се окислява до Н 3РО 4; в) водороден прекис се окислява до молекулен кислород.
3. В реакцията на Н 3РО 4 фосфорна киселина с калиев хидроксид образува сол - калиев дихидроген фосфат. Добави реакцията, и определяне на броя на еквивалентност на моларна маса еквивалент на алкални, киселини и соли в реакцията.
4. В промишлеността много метали, получени под действието на водород в техните съединения. Изчислява се маса от метал и неговия окис еквивалент, ако възстановяване на 0.27 тегловни вода формира метален оксид тегло на 1.2 грама водород Call този метал, ако неговата валентност равно на две.
5. Изчислете моларната маса на еквивалент сярна киселина до следните реакции:
а) Zn + H 2 SO 4 (разредена) → ZnSO 4 + Н2
б) 2HBr + H 2 SO 4 (конц) → Br 2 + SO 2 + 2Н 2О в) 8HI + H 2 SO 4 (конц) → 4I 2 + H 2 S + 4Н 2О
За да продължите с изтеглянето, което трябва да се съберат на снимка: