Протеини като полиелектролити
Полиелектролитите - ВМУ е съставен от макромолекули, които съдържат групи, способни на йонизация в разтвор. Полиелектролитите съдържат голям брой йонни групи ( "поли") и техните разтвори са способни на преминаване на електрически ток ( "електролити"). Йонни групи могат да бъдат киселинни или основни и киселинни и базични в същото време.
За полиелектролити включват някои смоли и флокуланти (вж. Точки 6.5 и 10.7)
киселина Карбоксилната група (-СООН) включва разтворим част от нишестето, и сулфо (-SO3) - разтворим част на агар-агар. Основните свойства на полиелектролитен определени амино група -NH2. Протеините са най-често срещаните полиелектролити. Освен киселина (-СООН) също протеини съдържат основни групи (-NH2) и други. По тази причина те могат да се считат амфолити.
Макромолекули протеин образува от аминокиселини (NH2-R-COOH). При взаимодействието на карбоксилни и амино групи се образуват пептидни връзки
О
||
-С-NH-, полипептидни вериги, които са протеини.
На правоъгълници затворени пептидни връзки, както и знаците "-" и "+" показва на презареждане, причинени от изместване на електронен облак и определяне хидрофилни макромолекули.
протеини макромолекулите възможни различни комбинации от полипептидни вериги, които се формират от само 20 аминокиселини прости. Броят на различни комбинации на тези киселини на броя на атоми, образуващи макромолекули (около 10 3 -10 4) и значителен брой конформационни степени на свобода (от февруари 10 -103). Поради тази причина, полипептидната верига може да отнеме много микроскопични конформационни състояния, от порядъка на 10 п (п - брой на аминокиселинни остатъци, която достига няколкостотин), който определя разнообразие от протеини.
Полипептидни вериги образуват първичната структура на протеини. който се отнася до ковалентна структурната основа на макромолекули и специфична последователност на аминокиселинни остатъци. Молекулно тегло протеинови макромолекули могат да варират от 1.2 # 8729; 10 април до 10 6.
Всичко това естествено срещащи се протеинови молекули идентични по състав аминокиселина, аминокиселинни последователности на остатъчни вещества и дължината на полипептид връзката. Например, човешка кръв хемоглобин се състои от 574 аминокиселинни остатъци и има молекулно тегло от 64,500.
Протеините в естественото им състояние, наречени местни и техните колоидни свойства зависят от макромолекулярно структура; отличава глобуларни протеини и фибриларна структура.
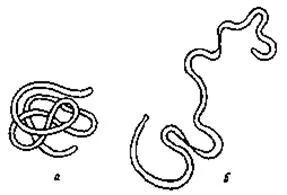
Macromolecules фибриларен протеин полипептидни вериги са удължени по една ос. Фибриларни протеини обикновено са неразтворими във вода. Фигура 20.1 показва фибриларна структура на протеина - кератин косата. Макромолекули кератин рана една върху друга, като по въже. В организма фибриларни протеини често извършват механични функции. Така, например, влакнести протеини са колаген и желатин - съставни части на кожата и сухожилията, както и миозин, която е част от мускула.
Протеините са способни да образуват глобули наречените кълбовидни (фиг. 20.2, а). Кълбовидните протеини се характеризират със специфичната форма на сгъване на полипептидната верига в пространството. Colloid-химични свойства на глобуларни протеини в манифест в по-голяма степен, отколкото на фибриларни. Повечето от полярни хидрофилни центрове [вж. формула (20.1)] макромолекулен протеин е извън глобули и това определя тяхната хидрофилност, добра разтворимост във вода и висока реактивност.
намерени Кълбовидните протеини в кръвта, лимфата, цитоплазмата на клетките. За протеини тази група включва албумини и глобулини яйчен белтък, мляко, кръвен серум, стомашен сок, пепсин и др.
20.1. Структурата на макромолекула фибриларен на кератин протеин
Съгласно концепцията на структурна и функционална организация на протеин макромолекула роден триизмерната структура на протеина макромолекула е напълно определена от аминокиселинната последователност съответства на минимално вътрешната енергия и на всички етапи от спонтанно коагулация протеинова верига преобладават междумолекулни взаимодействия на несвързана атоми на междумолекулни взаимодействия; където нативната конформация на протеини макромолекула трябва да се споразумеят междумолекулни взаимодействия на несвързана атома.
Вътрешномолекулни взаимодействия, които се реализират чрез водородни връзки, Ван дер Ваалс и електростатични сили могат да бъдат къси, средни и далечни разстояния. Близо определят минималните конформационни възможности в рамките на всеки аминокиселинен остатък, средно - комбиниране на най-благоприятни структурни остатъци в местните части от веригата на протеин и далечни взаимодействия са сведени до образуване между всички части на протеина стабилизиращ контакти верига.
В организацията на глобули на протеини, съществени междумолекулни взаимодействия са хидрофобни (вж. Раздел 5.5). въглеводород странични вериги не са киселинни остатъци за предпочитане са в контакт един с друг, а не с полярни молекули вода. Обратно, странична верига предпочитат да взаимодействат с вода. В резултат на веригата на протеин може да се сгъва в глобули така че неполярни остатъци чрез хидрофобни взаимодействия ще бъдат във вътрешността на макромолекулата и полярни остатъци ще бъдат разположени върху повърхностите на глобули в контакт с вода.
В допълнение към прост протеин, състоящ се от аминокиселинни остатъци, има сложни протеини, съдържащи различни групи от атоми. За сложни протеини включват хемоглобин, който включва zhelezoporfirinovy комплекс; гликопротеини, съдържащи въглеводород молекула; нуклеопротеини, които съдържат нуклеинова киселина, както и липопротеини, които включват молекули на мазнини и стероиди.
В допълнение към биологични протеини ВМС са нуклеинови киселини намерени във всички видове жива материя. остатъци фосфорна киселина, включени в макромолекулата на нуклеинова киселина, защото техните свойства като киселинен полиелектролити. Също остатъци от фосфорна киселина, нуклеиновата киселина включва други групи от молекули, по-специално peptozanovyh захариди.
Дезоксирибонуклеиновата киселина (ДНК) съдържа деоксирибоза. ДНК заедно с рибонуклеинова киселина (РНК) в живото тяло изпълнява важна биологична функция: определя програмите наследственост и протеин синтезата.
Ако протеин характерната способност за самоорганизация е активната съставка на живота, ДНК действа като потенциален неговото начало. Синтез на протеини в организма се осъществява съгласно генетичния код, присъщи на структурата на нуклеинови киселини.
Протеин - уникално творение на живите организми. Тъй като продуктите от техния живот, те предоставят възможност за съществуването и развитието на организма.