правило фаза

Ледена вода - хетерогенна система (двуфазна хетерогенна един компонент)
По отношение на терминологията на всеки разтвор е еднакво правилно да се каже като хомогенна система, и като хомогенна система една фаза. но кубчета лед в вода - като не-хомогенна система, и като хетерогенна система двуфазна. Избор на най-подходящия план зависи от формулирането на проблема, тъй като разликата от гледна точка на "термодинамична система" и "термодинамична фаза" отразява разликата в подхода към описанието на системата и фаза. При фаза може да се разбере комплект, използван за описанието на интензивни променливи [3] [4]. Такова интензивно величина като плътност, специфична топлина, коефициент на термично разширение и др. Характеризират термодинамичните свойства на отделните вещества или фаза образуване на разтвор. Самата концепция за термодинамична фаза беше въведен Гибс да "имат термин, който се отнася само за състава и термодинамична държавата [...] на тялото и за които тя не е от значение размерът му или неговата форма" [5] във връзка с правилото за фаза отказ въз основа на използването Гибс - Duhem. От това следва естествено принадлежност A. V. Storonkinu откриване фаза като отделно вещество или разтвор при всички възможни условия, което позволява съществуването на описанието от едно уравнение, която експресира връзката между променливите на състоянието [6] - уравнение Gibbs - Duhem или всички от каноничните уравнения на състояние. Предпочитание Гибс уравнение - Duhem, се дължи на факта, че всички независими променливи в това уравнение представлява стойността на интензивност.
Съставът на всяка фаза се определя от съотношенията на компонентите (моларни или маса). Съотношението на всеки компонент отсъства във фаза под внимание, се счита за нула [7]. Използване на мол фракции изисква използването на всички фази на същата формула блок за изчисляване на броя на моловете на компонент [8]. Обикновено, когато се разглеждат равновесие фаза основава на факта, че химическа трансформация в хетерогенна система вече е взето предвид при изчисляване на броя на компонентите, така че химическите реакции в системата са взети под внимание, [9].
От време на време в дефиницията на "фаза" е термин, въведен изискване не само от термодинамичната идентичност, но като цяло всички макроскопски свойства на веществото. Например, оптично активни кристали дясно- и лявовъртящи (кварц. Калиев хлорат и т. П.) Оферта разглежда като две различни фази, различни кристалографски параметри. Въпреки това, неговите термодинамични свойства на тези вещества са идентични и са традиционно се счита една фаза [10].
В термодинамиката Gibbs при разглеждането хетерогенна равновесие вещество преди и след прехода фаза се счита за една фаза [10]. Например да разгледаме една единствена фаза α-Fe (ферит) с феромагнитни свойства - стабилна под точката на Кюри (769 ° С) желязо полиморф. и β-Fe - полиморф различен от α-Fe магнитен (парамагнитен).
За да се определи термодинамична състоянието на системата, т.е. съвкупността от неговите свойства, недостатъчно познаване на свойствата на фазите, съставляващи системата: .. набор от независими променливи на системата трябва да бъдат представени най-малко един богат количество, например обема или масата на система [11].
Термодинамичните степени на свобода, така и за разсейването на общото разсейване на системата
В термодинамиката, всеки независим интензивно състояние променлива, чиято стойност може да се променя произволно, при условие че фазите, които са в системата, която не изчезва, а се формират нови фази, съответства на термодинамична една степен на свобода. Брой на степените на свобода (вариацията) на системата е броят на независимите интензивни променливи (за външни минерални системи е налягането, температурата и съотношението на компонентите в различни фази), стойността на които е необходимо да знаете, за да опишем напълно състоянието на всички фази на системата, както и че може в същото време произволно, без да променяте броя и естеството на фазите (фаза на системата, без да променя състав) [12] [13] [7]. Броят на степените на свобода на системата се проучва е разликата между броя на интензивни променливи, достатъчни за неговото пълно описание, както и броя на връзки между тези променливи, т. Е. равен на броя на независими променливи, които позволяват произволно отклонение, не води до промяна в характера на система [14].
Броят на независимите променливи необходими за определяне на състоянието на системата, като се вземе предвид масата на всички фази, се нарича пълна (общо) дисперсията на системата [11] [15].
Вариацията и общото разсейване може да само не-отрицателни стойности число и техните най-малките стойности са нула [12].
В момента има три съставни вещества и химична реакция, без допълнително ограничение уравнения (тъй като при всяка фаза едно вещество), така че двукомпонентна система. .. затворена система, т.е. произволна промяна в компонентите на акциите не може да бъде; Thermodeformation система, т.е.. Д. За работа по системата може да се промени на температурата и налягането. Опитът показва, че за да се опише състоянието на системата, само една стойност. Ако системата за избор на променлива температура, равновесното налягане на въглеродния двуокис в затворена система е еднозначно определена от зададената температура и не може да се променя произволно, без да губи една от фазите [16].
Допусканията, използвани в получаването на правилото за фаза
Практическото приложение на фаза управлява конкретен проблем включва предположения предварително квалифицирани съответствие обикновено се използват в получаването на това правило [17]:
- системата е фаза на равновесие;
- само помисли обемна (триизмерна) фаза, двуизмерен (повърхностно) фаза са изключени от разглеждане;
- границата между фазите са плоски, не възпрепятства изравняването на налягането и температурата в системата и вещества за трансфер между фазите;
- въздействие сила полета (.. гравитационно, магнитни и т.н.), не са взети под внимание и на всички общи координатите термодинамичната вземат предвид само обема и теглото на компонентите, т.е., това само термичната деформация на системата - .. отворени и затворени.
Правилото за фаза е приложима само за системи, които са в състояние на термодинамично равновесие. В природата, това равновесие е обикновено отсъства. Например, през пролетта на леда се топи и изчезва в студения сезон, вода замръзва и съвместното присъствие на лед и вода - временно явление. Ако тази система не се изпълнява всичко възможно равновесие кинетични причини (твърде малък размер на процеси, водещи до равновесие), а след това направи с помощта на заключенията на фаза правило не могат да съответстват на реалните наблюдения.
изискване фаза равновесие съответствие не позволява изключване (за равновесие метастабилни фази общо приложими [18]), като има предвид липсата на други от горните допускания доведе до модификация на формулите за фаза правило [17].
Текстът на правилото за фаза за различни системни условия изолация
Математическият формулирането на фазите зависи от правилата, наложени на системата за изолация [19] [20]. Изолация материал не влияе на броя на фазите в хетерогенна система, но прекъсва връзката между броя на фаза и дисперсията на системата в случай, когато броят на фазите е по-малък от или равен на броя на компонентите [21]. Ако освен отношенията изразени от състоянието на изолационен материал, други уравнения на връзката между интензитета на фазите на редуващи, разсейването и общото разсейване на системата ще бъде по-малко от броя на тези уравнения.
отворена система
Броят на степените на свобода (брой на интензивни променливи, които могат да бъдат едновременно определени произволни стойности) ι многокомпонентен отворен хетерогенна система в равновесие чрез намиране на съотношението, което е математически формулирането на фаза правило Гибс [2]:
ι = 2 + к - F (ι = 0. 1. 2.).
(Фаза правило за отворени системи)
2, когато - броят на степените на свобода, което съответства на налягане и температура; к = 1. 2. 3. - броя на компонентите на системата; е = 1. 2. 3. - броят на фазите в системата.
Слушайте това правило всички отворени равновесни системи, състоящи се от произволен брой фази и всякакъв брой компоненти (присъствието на всеки компонент във всяка от фазите не се очаква [22], [23]).
Директно от правилото за фаза трябва да е ограничение за броя на съпътстващи фази в системата:
(Ограничаване на броя на фазите на съпътстващи в системата)
(Максималният брой на фазите в хетерогенна система)
При използване на уравнения за системи, в които е фиксиран определен брой параметри, броят на степените на свобода се намалява броят на фиксирани параметри [12]. Така кондензирани системи (например, метални сплави), когато налягането непрекъснато или неговия ефект върху състоянието на равновесие може да се пренебрегне, дисперсията на системата е по-малко от дава с уравнението Gibbs за разсейването на отворени системи [2].
За системата за еднокомпонентна
ι = 3 - F (ι ⩾ 0).
(\ Йота \ geqslant 0)>
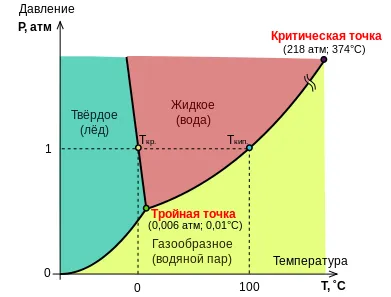
Диаграмата фаза на водата
От това следва, че максималният брой на фази в система с един компонент се постига с минимум (нула), неговата вариация е равна на три; нито налягането нито температурата на системата един компонент на трифазен не може да бъде произволно. В диаграмата фаза съответства на съвместното съществуване на три фази тройна точка с фиксирано налягане и температура. В друг температура, налягане, или други три равновесни фази не е възможно: системата ще бъде промени, които водят до една или две фази изчезват.
В случай enantiotropii и превръщане на една полиморфна фаза към друга състояние на постоянно налягане намалява променливостта на системата 1, така че превключване е възможно само в една строго определена температура (е = 2. к = 1. ι = 1 + к - F = 1 + 1 - 2 = 0
Двуфазен равновесие в системата компонент (е = 2. ι = 1
\ Йота = 1>) съответства на линията на диаграмата фаза. Температурата на системата може да се прилага произволна стойност, но по този начин налягането равновесие в двете фази ще определи недвусмислено.
Ако една фаза (F = 1. ι = 2
.. \ Йота = 2>), след това броят на степените на свобода на системата е две, т.е., температура и налягане може да се прилага произволни стойности в рамките на определена област на диаграмата фаза - докато системата е включена една от линиите на двуфазна равновесие. Най-простият пример на система за един компонент е единична фаза течност. под налягане, което е по-високо от налягането на парите му при дадена температура; в този случай парата не би било над течността, г. е. система еднофазен ще бъде [25].
(Пълен вариант на една отворена система)