Практическа работа № 5
Задачи. 1. Получаване на мрамор въглероден диоксид чрез взаимодействие със солна киселина.
2. Изследване на някои физични свойства на въглероден диоксид (IV) (цвят, мирис, разтворимост във вода, специфично тегло).
3. а) взаимодействие на въглероден диоксид с вода, б) извършване на следните превръщане;
4. Разпознаване на варовик Сред нерешените минерални образци.
5. Вземете бариев карбонат чрез метатеза.
Оборудване. Устройство за газове, опитни парчета мрамор и солна киселина, лабораторни статив стоят с епруветки, пипети, мерителни чаши с 150 мл (2 бр.), Картон кръга за да стъклени probirkoderzhateli (2 бр.), Нагревател.
Вещества. 10% разтвор на натриев карбонат и бариев хлорид, 10% солна киселина, вода вар, лакмус разтвор, дестилирана вода, минерали, гипс, каолин, варовик, кварц.
1. Получаване на въглероден оксид (IV). Зареждане на устройството за получаване на въглероден диоксид (фиг. 22.4). Вземи въглероден диоксид, да се събере в чаша и се покрива картон кръга. (Защо?)
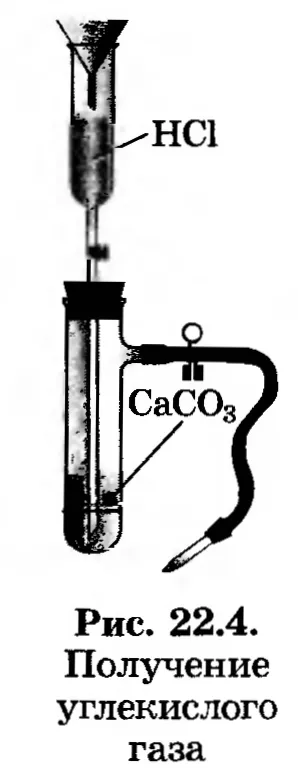
2. Изследване на свойствата на въглероден оксид (IV). Направете стъкло запалена клечка кибрит. Какво да гледам? "Pour" на съдържанието в друг стъкло. Уверете се, с помощта на горяща мачове, че въглероден диоксид означава "преливане" от една чаша в друга.
Какво въглероден диоксид имот е в основата на този опит? Опишете физичните свойства на газа за изпитване.
Излива се тръба (1/4 от нейния обем) дестилирана вода, лилаво оттенък си опън
крадец реакция и се прекарва през вода въглероден диоксид, за да промените цвета на индикатора. Защо да промени цвета на лакмуса? Направете подходяща реакция уравнение. Загрейте съдържанието на тръбата преди началото на кипене. Защо промените цвета на лакмуса отново? Обясни с помощта на уравнението на реакцията.
3. прилив тръба (1/4 обем) и вар вода пропускане през него въглероден диоксид. Какво да гледам? Когато се използва в практиката на тази реакция? Продължи да премине въглероден диоксид чрез мътен смес до пълно избистряне на разтвора. Какво се случи? Направи уравнението на наблюдаваните реакции.
Съдържанието на епруветката с полученият калциев карбонат се разделят на две равни части. В една епруветка, добавя вар вода, и други топлина преди разтвор на кипене. Какво да гледам? Обяснете какво се случва феномен с помощта на уравнението на реакцията. Направят изводи: а) колко карбонатите могат да бъдат превърнати в въглеводороди, и б) как да се трансформира бикарбонатите в карбонати.
4. Защото, издаден инертни материали от химически реакции определят варовик. Направи йонни уравнения, извършени от реакцията.
5. Вземете реакция обмен на бариев карбонат. Емпирично докаже, че утайката е наистина карбонат. Уверете се, дълги и къси йонни уравнения на прави реакции.
Картон кръг покритие стъкло не летливо въглероден диоксид.
Когато правите стъкло с мач въглероден двуокис излиза, защото Въглеродният диоксид не поддържа горенето. Въглеродният диоксид може да се излее от една чаша в друга, тъй като тя е по-тежък от въздуха и се установява в долната част.
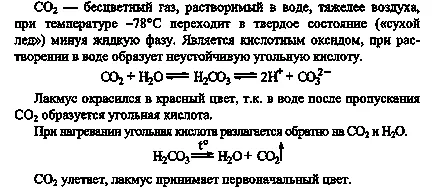
Има мътност на разтвора, в практиката се използва в оправдаят хаотичните стени. Реакцията се извършва:
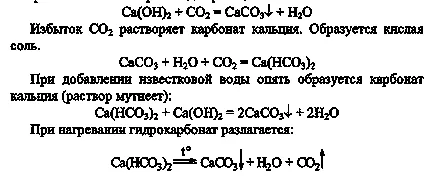
а) карбонати могат да бъдат превърнати въглеводороди чрез прекарването им през въглероден диоксид;
б) въглеводороди могат да бъдат превърнати в карбонати чрез нагряване или чрез добавяне на вар вода.
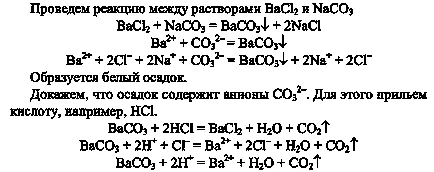
При условие, газ, който не поддържа горенето.