Потенциалът на електрод
Потенциалът на електрод настъпва при граничните RUB раменете veniya-метал с течност, като например вода или водно-състезания създава метална сол. Символ система M + Z / M, където М + Z - потенциал метални катиони (окислена форма), отбелязва функция раздел граници разтвор - твърда фаза, М - метал (редуцирана форма).
Ние считаме, че процесите, които протичат по време на потапяне IU талия във вода. Между метални катиони в решетката на металната повърхност и водни диполи електростатичните сили възникват йон-дипол взаимодействие. Тези катиони Ki топлинна кинетична енергия, която е достатъчно голяма движение, отделена от металната повърхност поради хидратация и ...
прехвърля във вода (окислителната реакция). Така IU талий отрицателен заряд поради излишък на електрони останалите и вода - е положителен поради това преминава в металните катиони. Разбира се, в процеса на преход катиони време задачи придружава от обратния процес - дехидро-TED преходни метални катиони от получения воден разтвор на метална повърхност (редукция). В общи линии, това уравнение може да се изрази редокс процес:
Когато металът е потопен в чиста вода в началния момент от време, скоростта на освобождаване на максимума на катиони и минимална скорост на входа, така просмукване Като метални катиони окисляване скорост процес изход намалява и влизането им в скоростта на твърда фаза се увеличава в резултат на DES и взаимодействие с него йони. След известно време, скоростта на изхода и входа катиони vayutsya-изравняване и равновесни установен в системата DES, където металната повърхност е отрицателно заредена, и разтворът - положителен (фигура 25.1, а.). Steady характеризиращ DES-рана потенциал равновесие електрод.
Ако металът не се потапя в чиста вода и воден разтвор на сол от него, в зависимост от естеството на метала и концентрация (активност) на йони в разтвор е възможно, че в началото на скоростта на преминаване метални катиони в разтвора ще бъде по-малка от скоростта на отлагане върху металната повърхност, т.е.. д. .В този случай, тъй като първоначалните предимствата на свободна samoproiz намаляване на метални катиони настъпва равновесие-ти DEL, където металът е положително заредена и тестван разтвор отрицателен (фиг. 25.1, б).
Следователно, с метални катиони преход Th-нарязани повърхност на метала - разтворът се винаги оформен и има потенциал електрод DES. Големината на електрод потенциал на р-ТА (М + Z / M) срещащи се в металната бикарбонат зависи от следните фактори:
- метален характер (своята решетка енергия, енергията йонизация на металните атоми и хидратация енергията на своите ка-тиони);
- активност (ефективна концентрация) на потенциалните-определяне йони в разтвор;
- температура на разтвор.
Потенциал възникващи в системата при стандартни състояние-вия, и се нарича стандарта означен е ° (M + Z / М +).
Xia потенциал стандартен електрод potentsialomnazyvaet произтичащи при състезания метал --create върху активността потенциални йони в разтвор 1 мол / л и температура от 298 К.
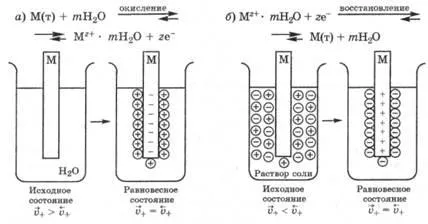
Фиг. 25.1. Появата на електродни потенциали:
и - когато металът е потопен в чиста вода; б - при потапянето ме-своето решение талий сол
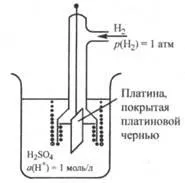
Фиг. 25.2. Стандартна водороден електрод
Абсолютната стойност на първи стандартен потенциал електрод на един електрод за измерване или брои-състезания не могат да бъдат, но могат да бъдат определени, за да споделят неговото значение по отношение на всеки електрод избрана като референтна. Според Международното споразумение за този така влагалището е стандартен вода-налното електрод.
В електрохимията използват стандартни потенциали, определени по отношение на стандартен потенциал водороден електрод, която стойност обикновено се приема, че е нула.
Стандартна водороден електрод е PLA-tinovuyu плоча, покрита с черна платина (насипно PLA-шлам), и понижава в разтвор на киселина, при което активността на водородните йони е 1 мол / л, и чрез което цялото време пропуска е много чиста, водород газ под налягане от 1 атм ( 101325 Ра) (фиг. 25.2).
Символ стандартен водороден електрод:
В обратим водород електрода процеси възникнат:
Потенциалът на стандартен водороден електрод конвенционално приета като нула при всички температури:
Трябва да се отбележи, че електрод водород не е много лесен за използване, но е важно в термодинамичен отношение, тъй като тя служи като основен стандарт, който се определя по отношение на неделящи потенциали на другите електроди. На практика, вместо водороден електрод като сравнителен електрод се използва широко сребро подреждане хлорид електрод и експлоатация кото-бодното ще бъдат обсъдени в сек. 25.6.
За определяне на потенциала на електрод електрод спрямо стандартен водороден-еска представлява Galvė верига (елемент) на двете половинки клетки: електрод тест и стандартен водороден електрод.
Електрическа верига е затворена система, мю, състояща се от два електрода, свързани с външна верига - електронен проводник (метал) и вътрешната верига - йон проводник (електролитни разтвори, Съед-nennye сол мост). В галванично верига настъпва превръщане на химическата енергия процеси на окисляване и редукция в електрическа енергия. В галванично верига разграничи електроди: анод и катод.
Anodomv електрохимията се нарича електрод за реакцията на съвместно окисление настъпва тор, т. Е. Recoil електрони трона.
Анодът на галванична верига е отрицателно заредена, и го изпраща на електроните в външен кръг. Анодът е винаги материал електрод, който лесно се окислява, например по-активен метал. За разлика от анода, разтвор анод поради натрупване него, излишък от положително заредени катиони.
Katodomv електрохимията наречен електрод за съвместно намаляване реакция протича тор, т. Е. Прайс-съюз на електрони.
Катодът на галванична верига е положително заредена и тя получава електрони от външния кръг. Катодът е елек-trodes на по-малко активни метални катиони, които лесно възстановени. За разлика от катода, катодния разтвор в Gal-верига vanicheskoy отрицателно зареден поради натрупването на аниони него.
Трябва да се помни, че при разглеждането на електро Отдава (когато електрическата енергия се превръща в химично) естеството на процеси, които се случват в електродите се поддържа, и анода и катода са обърнати знаци.
Когато за допълнителни описания на галваничен анод Vo лед веригата ik- наляво, надясно катод. Интерфейсът между електрод и разтвор, в който тя е пропуснат, един определен ред, и електролитен мост, свързващ анодните и катодните разтвори, обозначени с две функции:
Когато е затворен галванично верига в него поради пространство разделяне правителствена окислителната реакция (анод) и RECOV-нето (катод) се появява посока движение на електрони от анода към катода през външна верига, и - йоните на вътрешната верига (електролитна мост). Благодарение на наличието на - посока на движението на заредени частици в галванична верига притежава превръщането на реакции на енергия оксидативен намаляване химически в електричество. По този начин, по време на, галванична верига може да бъде химически-Ками източници на ток.
Способността на галванична верига за прехвърляне на електрически заряди характеризира електродвижеща сила (EMF).
Tsepiopredelyaetsya галваничен електродвижещо като разлика на потенциалите на катода и анода: FK = E - F.
В галванична верига оперира спонтанно потенциал анод е винаги по-малък от катодния потенциал и неговото електродвижещо напрежение - бяха ранг-позитивен (Е> 0).
Измерване на електродните потенциали. Ако измереното едн галванично верига, състояща се от теста и стандартен водороден електрод, е възможно да се определи стойността на електрон - електрод потенциал на тест електрод.
Стойността на потенциал електрод числено равно на галванична верига EMF състои от стандартен в пълен електрод и потенциала на електрода е да се определи и има знак "+", ако протича процес на възстановяване, и знака "-", ако процесът на окисляване.
Помислете за някои примери. Определя стойност мелница стандарт електрод потенциал на цинк на капки в разтвор на цинков сол, в която катиони активност (Zn2 +) = 1 мол / л. Както цинк се окислява лесно от водород, галваничен верига кал цинков електрод е анод, и стандартен водороден електрод - (. Фигура 25.3) катод.
Пишем верига, съставена галванични Вериги
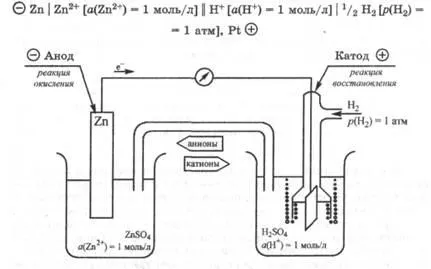
Фиг. 25.3. Електрическа схема за измерване на капацитета на електрон-стандартен електрод на цинков електрод
Това галваничен EMF верига е равна на разликата между катода и анода на потенциала за:
Ние дефинираме стандартната потенциал на мед електрод, ако EMF галванично верига, съставена от определената стандартен водороден електрод и е равна на 0,34 V.
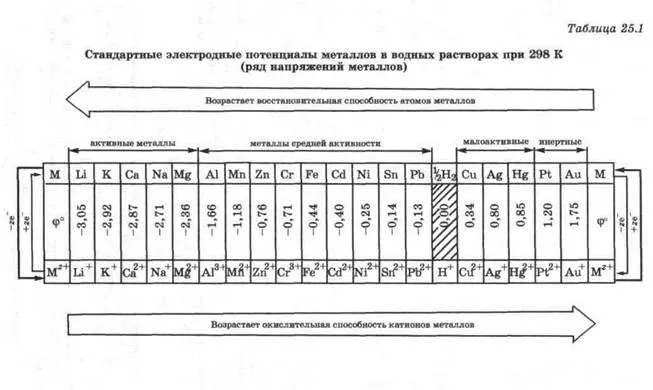
Големината на стандартната потенциал електрод на металния ха характеризира способността му да дари електрони, и има постоянна yannoe за всеки метал стойност. Стандартни електродни потенциали на метали са показани в таблица. 25.1.
Няколко napryazheniy- метали в това място в един ред увеличава техните стандартни електродни потенциали са.
Сред тези метали натоварвания, които даряват електрони по-лесно от водород, са оставени от водород и имат отрицателно-стойности на стандартни електродни потенциали. Тези метали, които даряват електрони по-трудно от водород, са отдясно на водород има положителни стойности и стандартното електрон-електрод потенциал. Колкото по-малка от стойността на е ° (M + Z / т), за променлив-тивна метал.
Уравнението на Нернст. Стойността на потенциала на електрод, кола-проникваща в метала - разтвора зависи от естеството на метала, неговата йонна активност в разтвор и температурата. Ефектът на всички тези фактори върху величината на електрод потенциал на метал-Nogo се изразява с уравнението Нернст:
където е ° - стандартна потенциал електрод; R - универсална газова константа, 8.31 J / (мол • K); Т - температура, К; R - зареждане потенциали tsialopredelyayuschih-метални йони; F - брой на Фарадей, 96500 C / мол; и (M Z +) - активност потенциал метални йони в разтвора в мол / л.
Ако въведете числените стойности на константи R и F и си отиват от натурални логаритми на десетични, уравнението на Нернст става: