Отговори на викторина на тема "халогени" (Gabrielyan)
Част А. Тестове с избор на отговор
1. Разпределението на енергия на енергийните нива в флуорен атом:
V. 2д, 7д.
2. От тях най-малките химични елементи атомната радиуса на атома:
Б. флуор.
3. От тях, химичните елементи в съединенията от голямото Електроотрицателност атом е:
Б. флуор.
4. Позицията на елемент бром в периодичната таблица:
W. четвърти период на основната подгрупата Група VII.
5. От тези вещества най-ясно изразени има окислителни свойства:
B.Ftor.
6. Външен хлор при нормални условия:
А. газообразни.
7. химичната връзка в молекулата флуор:
Б. Ковалентното неполярен.
8. двойка на съединения с формули, всяка от които комуникират само ковалентна неполярен:
V.S12 H2.
9. флуорид разтвор във вода не може да се получи, защото:
G. Флуор реагира с вода.
10. хлор взаимодейства с разтвор на вещество, чиято формула е:
Б. NaBr.
Част В. цели с безплатен отговор
11. Дай примери йодни съединения, в които образува ковалентна неполярен, йонни и полярен ковалентна връзка. Отговорът илюстрира схема на образуването на химически връзки.
I2: I # 804; # 776;: I на # 804, # 776;:
HI H: I # 776; # 804;:
KI К- [I] +
12. Добави уравнението молекулни реакции, чрез които да извършват следните трансформация:
Cl2 -> НС1 -> NaCl -> AgCl.
1 Помислете реакцията по отношение на съпротивление на спукване.
CL20 + Н20 = 2Н + Cl-
CL02 + 2 * 1д = 2Cl- окислител
Н20 - 2 * 1д = 2Н + редуктор
HCl + NaOH = NaCl + H2O
NaCl + AgNO3 = AgCl ↓ + NaNO3
13. Както признават разтвори на калиев хлорид и калиев нитрат? Запишете молекулни, пълни и кратки йонни уравнения.
Добавяне на сребърен нитрат, ин витро калиев хлорид валцувани бяла утайка.
KCl + AgNO3 = AgCl ↓ + KNO3
К + + СГ + Ag + + NO3- = AgCl ↓ + K + + NO3-
СГ + Ag + = AgCl ↓
14. халид в лабораторията получава чрез взаимодействие на концентрирана сярна киселина с метални халогениди.
Съгласно реакционна схема
NaF (T) + H2S04 (KOH4) -> NaHS04 + HF ↑
Изчислява маса халид получава от 2 мола натриев флуорид.
п (HF) = N (NaF) = 2 мола
m (HF) = 2 mol х 20 г / мол = 40 грама
име 15. Запис и формула на вещество, което се използва за дезинфекция на водата, избелване плат и хартия.
хлор (Cl2) и неговите връзки.
Белина, белина: Са (OCl) 2 • CaCl2 • Са (ОН) 2 • 2H2O
Част А. Тестове с избор на отговор
1. Разпределението на енергия на енергийните нива на хлорен атом:
G. 2д, 8д, 7д.
2. От тях, най-големите химически елементи атомната радиуса на атома:
Б. йод.
3. От тях, химичните елементи в съединенията от малката Електроотрицателност атом е:
Б. йод.
4. Регламент на хлор елемент в периодичната таблица:
Б. третия период, основната подгрупата Група VII.
5. От тези вещества най-ясно изразени свойства за намаляване има:
Б. йод.
6. Външен флуор при нормални условия:
А. газообразни.
7. химичната връзка в молекулата на йод:
Б. Ковалентното неполярен.
8. двойка на съединения с формули, всяка от които комуникират само ковалентна полярен:
В. НС1, НВг.
9. името на халоген, който е бил използван в борба като токсично вещество:
G. хлор.
10. Бром не реагира с веществото, формулата на които:
А. NaCl (р-р).
Част В. цели с безплатен отговор
11. примери за хлорни съединения, в която образува ковалентна неполярен, йонни и полярен ковалентна връзка. Отговорът илюстрира схема на образуването на химически връзки.
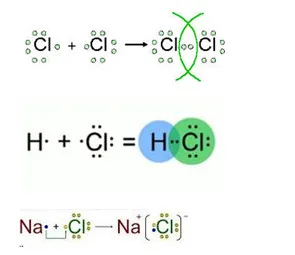
12. Добави уравнението молекулни реакции, чрез които да извършват следните трансформация:
NaCl -> Cl2 -> CuCl2 -> AgCl.
1 Помислете реакцията по отношение на съпротивление на спукване.
1. 2NaCl + 2H2O -> Н2 + Cl2 + 2NaOH
Анод: 2Cl (-) - 2е (-) -> Cl2 (0)
Катод: 2H2O + 2е (-) -> Н2 + 2ОН (-)
2. Cl2 + Cu = CuCl2
CuCl2 + 2AgNO3 = 2AgCl ↓ + Cu (NO3) 2
13. Както признават разтвори на натриев бромид и натриев нитрат? Запишете молекулни, пълни и кратки йонни уравнения.
Взаимодействие със сребърен нитрат. Ин витро бромид утайка падане.
NaBr + AgNO3 = AgBr ↓ + NaNO3
Na + + Вг + Ag ++ NO3- = AgBr ↓ + Na + + NO3-
Ag + + Вг = AgBr ↓
14. халид в лабораторията получава чрез взаимодействие на концентрирана сярна киселина с метални халогениди.
По схемата
Nal (T) + H2S04 (KOHTS) -► NaHS04 + Hl ↑
Изчислява се теглото на халогеноводород, получен от 1,5 мол натриев йодид.
п (HI) = N (натриев йодид) = 1,5 мол
m (HI) = 1,5mol * 127 г / мол = 190.5 грама
15. Запишете наименованието и символа на халоген съединение, което се използва за успокояване на нервната система.
бром, Br2
Част А. Тестове с избор на отговор
1. Разпределението на енергия на енергийните нива в бромен атом:
V. 2д, 8д, 18e, 7д.
2. От тези химикали-голям радиус на атома:
Б. йод.
3. От тях, химичните елементи в съединенията от малката Електроотрицателност атом е:
Б. йод.
4. Позицията на флуор елемент в периодичната таблица:
А. вторият период, основната подгрупата Група VII.
5. От тези съединения, изразени от най окислителни свойства има:
Б. йод.
6. Външен йод при нормални условия:
Б. Твърдо вещество.
7. химичната връзка в молекулата на бром:
Б. Ковалентното неполярен.
8. двойка вещества с формули в които всеки от връзката на молекулите само йон:
Б. NaCl, KBr.
9. имота не е характеристика на флуор:
Б. Най пасивни.
10. хлор реагира с веществото, формулата на които:
G. Н2.
Част В. цели с безплатен отговор
11. Дай примери бромни съединения, в които образува ковалентна неполярен, йонни и полярен ковалентна връзка. Отговорът илюстрира схема на образуването на химически връзки.

12. Добави уравнението молекулни реакции, чрез които да извършват следните трансформация:
НВг -> KBr -> Br2 -> SaVg2.
2, помислете за реакцията от гледна точка на съпротивление на спукване.
1. 2HBr + = 2K 2KBr + Н2
2. 2KBr- + CL02 = KCl- + Br02
Cl2 (0) + 2е (-) -> 2Cl (-)
2Br (-) - 2е (-) -> Br2 (0)
3.
13. Както признават разтвори на натриев йодид и натриев нитрат? Запишете молекулни, пълни и кратки йонни уравнения.
Взаимодействие със сребърен нитрат - качествена реакция хлорид, бромид и йодид йони. Утайката от сребърен йодид - жълт.
Натриев йодид + = AgNO3 с Agl ↓ + NaNO3
Na + I- + Ag + = NO3- с Agl ↓ + Na + NO3-
I- + Ag + = с Agl ↓
14. халид в лабораторията получава чрез взаимодействие на концентрирана сярна киселина с метални халогениди.
По схемата
NaBr (T) + H2S04 (KOHTS)> NaHS04 + НВг ↑
Изчислява маса халид получава от 0,5 мола натриев бромид.
п (НВг) = N (NaBr) = 0,5 мол
m (НВг) = 0,5mol * 80 г / мол = четиресетграма
15. Запишете наименованието и символа на халоген съединение се прибавя към пастата за предотвратяване на зъбен кариес.
F2 флуор
Част А. Тестове с избор на отговор
1. Разпределението на енергия на енергийните нива в йоден атом:
V. 2д, 8д, 18o, 18e, 7д.
2. От тези химикали-голям радиус на атома:
Б. йод.
3. От тях, химичните елементи в съединенията от малката Електроотрицателност атом е:
Б. йод.
4. Предоставяне на йод елемент в периодичната таблица:
Г. 5-ти период, основната подгрупата група VII.
5. От тези вещества най-ясно изразени свойства за намаляване има:
Б. йод.
6. Външен бром при нормални условия:
В. Течни.
7. химичната връзка в молекулата на хлор:
Б. Ковалентното неполярен.
8. двойка на съединения с формули, всяка от които комуникират само ковалентна полярен:
Б. HI, S02.
9. алкохолен разтвор на халоген се използва за лечение на рани:
Б. йод.
10. бром взаимодейства с веществото, формулата на които:
Б. Н2.
Част В. цели с безплатен отговор
11. Дай примери на флуорни съединения, в които образува ковалентна неполярен, йонни и полярен ковалентна връзка. Отговорът илюстрира схема на образуването на химически връзки.
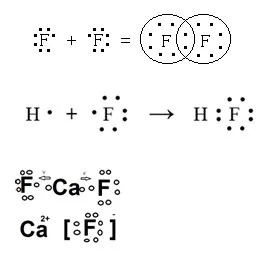
12. Добави молекулни реакционни уравнения от които трансформация могат да се извършват:
HI -> KI -> I2 -> ALI3.
2, помислете за реакцията от гледна точка на съпротивление на спукване.
1. HI + КОН = К + H2O
2. 2KI- + CL02 = 2KCl- + I02
2I (-) - 2е (-) -> I2 (0)
Cl2 (0) + 2е (-) -> 2Cl (-)
3. 3I2 + 2AL = 2AlI3
13. Както признават разтвори на натриев бромид и натриев нитрат? Запишете молекулни, пълни и кратки йонни уравнения.
Взаимодействие със сребърен нитрат - качествена реакция хлорид, бромид и йодид йони. Утайката на сребърен бромид -bledno жълто.
NaBr + AgNO3 = AgBr ↓ + NaNO3
Na + + Вг + Ag ++ NO3- = AgBr ↓ + Na + + NO3-
Ag + + Вг = AgBr ↓
14. халид в лабораторията получава чрез взаимодействие на концентрирана сярна киселина с метални халогениди. По схемата
NaCl (T) + H2S04 (KOHTS) -► NaHS04 + HCl ↑
Изчислява се теглото на халогеноводород, получен от 3 мола натриев хлорид.
п (HCl) = N (NaCl) = 3 мола
m (HCl) = 3 мола * 36,5 грама / мол = 109.5 грама
15. Запишете наименованието и символа на халоген съединение се прибавя към готварска сол за профилактика на заболявания на щитовидната жлеза.
йод I2