Определяне на метални еквиваленти
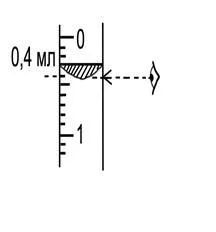
След това, в една реакционна коляното тръба 3, се поставя парче метал. метална маса, посочена върху хартия, в която се е увила, бележка в таблица. 1.1.
В друг коляното изсипва тръба 3 с разтвор на солна киселина в трета обем. Плътно поставен върху тръба 3 в тапа 5 тръба пара.
Отново проверка на уреда за течове. Ако устройството е затворен, показанията на нивото на водата (V1) в стъкленица запис на измерване в таблицата.
Подемно тръба 3 се излива киселина в коляното с метал. Зараждащата водород изместват вода от бюрета в бюрета 1 2. След завършване на реакцията (спиране на отделянето на водород), изчакайте 3-5 минути до съдържанието на реакционните тръби се охлаждат до стайна температура.
След спомагателни бюрета 2-ниска, така че нивото на водата в двете бюрета на същата височина. При равни нива на вода във вътрешността на устройството до атмосферно налягане.
В това положение бюрети измерване на нивото на водата (V2) в записа на измерване бюрета 1 и таблица. 1.1.
1. Определяне на парциалното налягане на водород.
Водната пара във въздуха има значително парциално налягане. За определяне на парциалното налягане на водород, е необходимо да се елиминира налягането на наситена водна пара, която се намира в Таблица 1.2 при подходяща температура опит.
- В края на работата -
Тази тема принадлежи на форума:
Когато се работи в лабораторията, трябва да спазват следните правила. На работното място се поддържат чисти и да не се поставят на работното място. Уверете се, че да не се замърси реагенти.
Какво да правим с получения материал:
Всички теми на този раздел:
Експерименталната и изчислява данните
Non данни Параметър Символ измерение числена стойност Тегло метал
Налягане на наситена пара
Температура, 0 ° С Температура на налягането, 0 ° С под налягане кРа mm Hg. Чл. кРа
подготовка разтвор
В съответствие с принципа на напречен (квадрат Pearson) се изважда от определен начин диагонали предварително определено количество (С%), за да се получи броя на тегловни части от изходни разтвори:
Концентрациите на реагенти
Обяснение опит в експеримент изследвали влиянието на концентрацията на натриев тиосулфат Na2S2O3 на скоростта на реакцията: Na2S2O3 +
Експерименталната и изчислява данните
Някои тръби Брой Концентрация Na2S2O3 разтвор капчици реакционно време т, с REA скоростта
температура
Обяснение опит в експеримент изследвали влиянието на температурата върху скоростта на реакцията на натриев тиосулфат с сярната киселина: Na2S2O3 + H2SO4
Експерименталната и изчислява данните
Стая температура експерименти, 0 ° С реакционната време Т, със скоростта на реакцията
катализатор
Обяснение опит катализатори са вещества, които променят (увеличаване или намаляване) на скоростта на химична реакция, но самата реакция остават непроменени. Най-
ОПИТ 4. Химично равновесие
Пояснение на опит в този експеримент изследва обем на реакцията на равновесие: FeCl3 + 3KCNS Û Fe (CNS) 3 + 3KCl.
тестови данни
Някои тръби добавени разтвор (Формула вещество) отслабване или укрепване оцветяващи разтвори равновесие изместване посока (посока
XP 1. Хидролиза на различни видове соли
Обяснение опит хидролиза - взаимодействие солена вода йони с йони. В тази форма слаби киселини и основи, промяна на рН на разтвора. Има три случая соли хидролиза.
Силни и слаби електролити
Слабите бази киселини Мощен Kdiss на Мощен Слабата Kdiss
тестови данни
Формула разполага сол база и сила киселина, сол индикаторна хартия образуване цвят кисела, неутрална или алкална среда,
Експеримент 2. Сравнение на хидролиза с киселина соли и средни
Обяснение опит Соли слаби киселини многооснов хидролизирани поетапно. В тази форма присъединителни с киселина соли. Например, соли хидролиза Na2CO3
Степента на хидролиза
Обяснение опит хидролиза сол, образувана слаба киселина и силна основа, следва схемата: A + HOH Û HA + ОН-. хидролиза константа
степен на хидролиза
Обяснение опит хидролиза сол, образувана слаба основа и силна киселина, следва схемата: R + + HOH Û КОН + Н +. Постоянното г
ОПИТ 5. Offset равновесие хидролиза
Определения За опит соли, образувани от силна киселина и слаба основа, силна основа и слаба киселина, по избор хидролизиране компенсират. К + HOH Û КОН +
ОПИТ 6. Влияние на температурата върху степента на хидролиза
Провеждане на опита: Реагенти разтвор 0.2 М натриев ацетат, CH3COONa; фенолфталеин показател. Леярската тръба 5 капки натриев ацетат СН3СО
XP 7. Взаимно ефект на соли на степента на хидролиза
Обяснение опит с едновременно разтваряне на соли (например, ZnCl2), оформен силна киселина и слаба основа и сол (например, Na2SO3), образува
1. ОПИТ намаляване свойства на металите
Обяснение опит елементи електрон отдаваща видове, т.е.. Д. като малък йонизационна енергия, наречен метали. Запалката атома дарява електрон, толкова по неговите метални свойства.
Експеримент 3. Окисление на катион Fe2 + да Fe3 + с кислород от въздуха
Обяснение опит висока окисление на повечето метали е най-стабилен. Затова Fe2 + катиони има тенденция да се движат в Fe3 +. Окислението се провежда в кислород
натриев сулфит
Провеждане на опита Реагенти: 0.5 N разтвор на калиев бихромат K2Cr2O7; 0.5 N разтвор на натриев сулфид Na2S; 0.1 N разтвор на сярна Kis
калиев нитрит
Провеждане на опита Реагенти: 0.5 N разтвор на калиев бихромат K2Cr2O7; 0.5 N KI разтвор на калиев йодид; 0.1 N разтвор на сярна киселина Н2
водороден прекис
Провеждане на опита Реактиви: 3% водороден прекис разтвор Н2О2; 0.5 N KI разтвор на калиев йодид; 0,05 N разтвор на калиев перманганат на KMnO4;
Опитът 5.1. Диспропорциониране реакция на натриев сулфит
Провеждане на опита Реагенти: Натриев сулфит Na2SO3 (Кр.); дестилирана вода; 0.5 N разтвор на меден сулфат (II) CuSO4. Най-
Опитът 5.2. Диспропорциониране взаимодействие на водороден пероксид
Провеждане на опита Реактиви: 3% водороден прекис разтвор Н2О2; разтвор на калиев бихромат K2Cr2O7 (конц.). п тръба
Опитът 6.2. Разлагане на амониев дихромат
Провеждане на опита реагенти: амониев дихромат (NH4) 2Cr2O7 Кр. Поставете щипка амониев дихромат (NH4) 2Cr2