Оя химически равновесие
Членка химикал. равновесие - състояние, при което изходните продукти и him.potentsial в по-равно, като се вземе предвид стехиометрия на процеса.
На химикала равновесие може да се говори при две условия:
Скорост предни и задни реакции са равни.
Равновесие съществува, ако външния натиск, а след това при отстраняване на системата се връща в изходно положение.
11.Zakon маса действие.
При постоянна температура, скоростта на химична реакция е пряко пропорционална на продукта от концентрациите на реагентите, взети в градуси, равна на стехиометрични коефициенти в уравнението на реакцията.
Например, за реакция амоняк синтез:
закон за действие на масата е както следва:
12.Konstanta равновесие в хомогенна система. Начини на експресия на константата на равновесие.
константа на равновесие - е константа, равна на съотношението на концентрациите на равновесие на крайните продукти и стартиране на реагентите, обединени в степен, съответстваща на стехиометрични коефициенти
Наречен хомогенни реакции в единична фаза: смес от газове в течна или в твърд разтвор понякога.
Начини за изразяване на константа равновесие
Ако концентрациите на веществата, участващи в реакцията, изразена в моларни единици моларност. т.е. в мол / л, е обикновено по-Kc
За хомогенна реакционна газова константа на равновесие на още по-добре изразен в парциалното налягане на вещества:
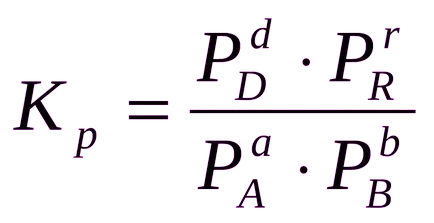
Понякога е удобно да се изрази константата на равновесие не е по отношение на парциалното налягане и концентрация, и редица вещества:
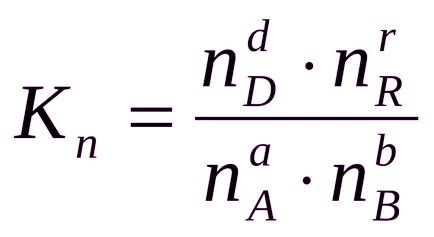
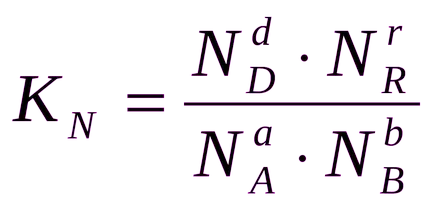
Като цяло, равновесната константа Ks, Кр и Кн са различни RN.
ако системата е в равновесие, е външно действие, равновесието се измества в посока, която намалява външно влияние.
14.Uravnenie isobars Van't Hoff.
този израз може качествено оценяване на въздействието на T на константата на равновесие и равновесие.
Фаза нарича - хомогенна част от хетерогенна система, като един истински интерфейс, в рамките на която всички свойства могат да варират непрекъснато, но по време на прехода, през който скок.
16.Sostavlyayuschie вещества и компоненти.
Компонент се нарича - минимален брой компоненти в по-достатъчно, за да се опише състоянието системи.
Veschestvaminazyvayutsya компоненти - вещества, които правят системата, която може да бъде възстановена чрез конвенционални техники на, и които могат да съществуват извън системата за неопределено време.
Степените на свобода на термодинамично равновесие на системата, от която само външните фактори, влияещи температура и налягане, на броя на независими компоненти се равнява на С = R-F + п (броят на външните параметри)
фаза правило показва, че броят на степените на свобода се увеличава с броя на компонентите и намалява с увеличаване на броя на фазите на системата.
18.Usloviya фаза равновесие в системата.
В хетерогенна система има равновесна фаза ако следните видове равновесие между фази:
Термични (температури между половете)
Механична (равно налягане)
Химическа за всеки компонент
където -ΔV- обем промяна вещество при прехода си от първата фаза на втория Т - температура на преход, АН - промяната в ентропията и енталпия на веществото в прехода на 1 мол вещество от една фаза към друга
Тя позволява да се оцени как температурата или налягането по време на прехода на фаза при смяна на параметъра 2.
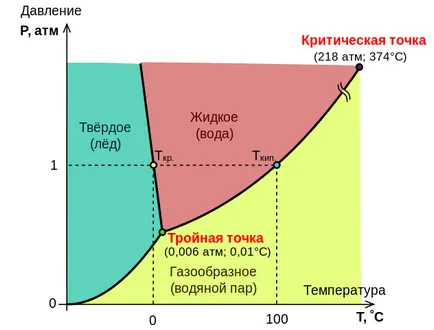
20. състояние диаграма на вода на
Връзката между количества, характеризиращи състоянието на системата, както и промени фаза в прехода на система от твърдо в течно, от течност в газообразно състояние
21.Istinnye разтвори. Методи за експресиране разтвор концентрация. Изчисляване на моларна маса и моларното съотношение на веществото и концентрацията на веществото в разтвора.
Истински разтвор - един вид на разтвор, където размерите на разтворените частици са изключително малки и сравними с размер на частиците на разтворителя.
Разтворите са газ (газова смес) течност itverdye. Газообразен разтвор е въздух. Морската вода - смес от соли във вода - течен разтвор. Твърдите разтвори - метални сплави. Разтворите се състоят от разтвореното вещество (а) в разтворител и.
Разтвор нарича твърд или течен хомогенна система, която се състои от два или повече компонента.
Разтворителят се счита - в за определяне на състоянието на разтвора или на които са по-големи по обем или тегло.
Методи за концентриране на разтвори на експресия.
концентрация разтвор - е теглото или броя на разтвореното вещество в определено количество, тегло или обем на разтвора или разтворител.
1) Тегло фракция (Wi) - е масата на разтвореното вещество, съдържащо се в 100 г разтвор.
3) molal концентрация (молалност) ИН - броя молове на разтвореното вещество, съдържащи се в 1 кг на разтворител [мол / кг].