Myosin - това
Фиг. 1. Схема миозинови молекули: 1-fibrillyarnyysterzhen; 2-главата.
Ръководител крушовидна форма: дължината им е приблизително. 20 пМ, и дебелината на 9,5-пМ и 5.5 пМ след точката на свързване към стеблото част. Последната се състои от две полипептидни вериги мол. т. прибл. 200 хиляди. Всяка (т. Наречен. Тежката верига) усукани спираловидно около един на друг. В главите с тежки вериги, свързани лека верига субединица с молекулно. т. прибл. 20 хиляди. на глава от населението се пада две леки вериги. Mol. м. цялата молекула е приблизително. 480 000.
След разцепване на трипсин M кратко два фрагмента образувани, притежавани до т.нар. лека и тежка HMM (обозначени съответно. СПТ и HMM). СПТ е част на стеблото част на молекулата М. прибл. 80 пМ и мол. т. 150 000. М. HMM включва част на главата и опашката дължина 60-70 нм, Mol. т. прибл. 340 000. Действието на папаин или дълго. излагане на трипсин отцепена от молекула М. глава (т.е.. се нарича. подфрагмента 1 или S1 мол. т. 120 хиляди. Род фрагмент HMM да-нето, разцепва под действието на папаин наречен. субфрагмент 2 (S2).
М. притежава ATPase активност; катализира хидролизата на АТР в ADP и Н 3РО 4 (това съобщение на отворен М. V. A. Engelgardtom и М. N. Lyubimovoy 1939). Активното място на М. ATPase намира в главата и запазва katalitich. комуникационни острови в тяхната proteolitich. разцепване. Съществено за активност са д-амино групи на лизин, аргинин, гуанидин групи, карбоксилни групи на глутаминова и аспарагинова до т.
Мускулите М. взаимодействие. с актин да образува и на m-тия и з и н о в о г т р л д С към, който играе важна роля в механизма на мускулната контракция. Центърът е отговорен за връзката с актин, също се намира в главата. Свързване с М в присъствието на актин. Mg2 + йони се придружават от многократно увеличаване на АТРаза активност. При ниска йонна сила в присъствието. АТР настъпва superprecipitation р-ТА, в резултат на рояк актомиози-нова сложни компреси и освобождава вода.
Един от най-DOS. St-MA-в неговата способност при ниска йонна сила да агрегира за да се образува добре подредени влакна, подобни на к-ryh присъства в мускулите. Роден нишка М е вретеновидна растение с диаметър от ок. 15 нанометра и 1500 нанометра. Опашки М. молекули са опаковани във вътрешността на спиралата, и глава намира извън под формата на издатини редовно разположени върху превръзката-STI. В центъра на спиралата на молекулата М. обобщени опашка към опашка, в резултат на зона не подкрепя глави. От двете страни на центъра на спиралата на молекулата М. обобщени полярен (главата до опашката). Една нишка съдържа 300-400 молекули М.
В механизма на свиването на мускулите, са важни две протеин тропомиозина и тропонин. Първо молекула (мол. М. 67-ти.) Е напълно изградени от а-спирали и се състои от идентични първичната структура фрагменти, съдържащи 42 аминокиселинни остатъци. Средата тропомиозина сол без полимеризира, образува вискозен структура с двойно пречупване. При взаимодействието. с F-актин-тропомиозина молекула пасва в канала, образуван от двойната спирала на актин. Troponin молекула е комплекс от три протеина, -troponina T (мол. М. 37-ти.), Troponin I (мол. М. 25). И тропонин С (мол. М. 20.). Troponin I-инхибитор актомиози-нова Mg-АТРаза активност, тропонин С може да се свързва Са2 + йони. Troponin I свързва актин, тропонин T с tropo-миозин.
Мускулни влакна конструирани надлъжно разположени фибрили (миофибрили) диаметър прибл. 1000 пМ, а за-ryh алтернативен светли и тъмни колела (съответно А и I колела ;. Фигура 2.). В средата на диск I е Z плоча, в рая, навлезе на всяко мускулните влакна, myofibril държи в гредата и организиране на тяхната позиция. Площта между две съседни плочи Z (. Така наречените в р да о т р д.) - функция единица миофибрили. Вътрешни миофибрили два вида влакна, ориентирани успоредно на надлъжната ос на мускулите, актин и миозин -filamenty на.
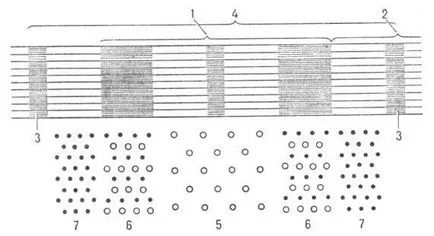
Фиг. 2. Частта на схема миофибрили надлъжен разрез (1 -disc А 2-диск I, 3-плоча Z, 4-саркомера); vnizupokazana напречно сечение диаграма миофибрили (5-tolkoniti миозинови, 6-актиновите нишки и влакна миозинови само 7-актин).
мускулна контракция се появява в резултат на плъзгане по нишки актинови филаменти М. (фиг. 3), поради периодичността. присъединяването глави М. да актинови филаменти и огъване vym молекули М в шарнирната област (има "тласък" на актиновите нишки). Релаксация се появява в резултат на разкъсване на напречни връзки М. и актинови филаменти и връщане в изходно положение.
Такава цикъл се инициира чрез получаване на сигнал от нервните окончания в мускулните влакна до позиция причинява освобождаване на Са2 + от sarkoplazmatich. ретикулум (сложна система от мембранни везикули, ограничена и тръбички т. наречен. цистерни ориентирани по миофибрили и проникващи мускулните влакна). Са2 + йони се свързват към тропонин С, агрегиран с актин и да причини промяна в конформацията на протеина. В резултат на това тропомиозина се премества настрана и не пречи на образуването на контакти между глави и М. актин. Когато дългата състоянието на края, Са2 + -ATPase -Mg 2+ sarkoplazmatich. ретикулум предизвиква обратен поток във вътрешния Са2 +. пространство ретикулум. Когато концентрацията на Са2 + достига достатъчно ниско ниво, контактите между глави и М. актин разкъсване на мускулните влакна и отпуска. Необходимата енергия за този процес е резултат на АТР хидролиза М.
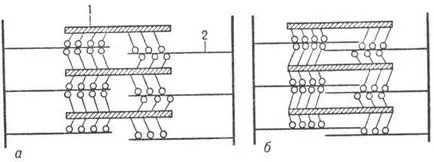
Фиг. 3. Схемата на набраздения мускул в покой (а) и при което неговата редукция (б); 1 - миозин нишки; 2 - актинови филаменти.
Лит. Poglazov BF Levitskiy D. I. миозин и биологична подвижност, М. 1982 BF Poglazov.
Химическа енциклопедия. - М. съветски енциклопедия. Ед. I. L. Knunyantsa. 1988 година.