Методи за определяне на повърхностното напрежение на фаза границите течаща
Повърхностното напрежение на течности е лесно да се определи експериментално. Методите за измерване на напрежението на течността повърхност (мобилни) интерфейси са разделени в три основни групи:
1) статични (методи капилярното покачване и легнало или висящи капка);
2) полу-статичен (метод максимална балон налягане, отлепване на пръстена, отделяне плоча, с тегло или преброяване капки);
3) динамичен (методи капилярни вълни колебания дюзи).
Най-точни резултати осигуряват статични методи, които се основават на проучване на фиксираната течност менискуса или профил на капки и мехурчета. В тези случаи, повърхността на течността е в равновесие с обема си и не се променя по време на измерването. използвани динамични методи, когато очакваното бързо установяване на равновесие между повърхностния слой и обемът на течността. В противен случай (когато появата на бавно равновесие) S получава стойности не са строго равновесие.
Всички техники, подходящи за измерване на напрежението на отделните течности повърхност и между резултатите, получени от статични и динамични методи, няма забележима разлика. В същото измерване и разтвори # 963; различни методи могат да се различават поради бавното установяване на разпределението на равновесие на разтвореното вещество между прясно образува повърхност и основния разтвор. Това важи особено за разтвори на мицелобразуващ повърхностно активни вещества и макромолекулна (протеинови вещества, сапонини, сапуни висши хомолози). Получаване на такива разтвори в стойности равновесие повърхностно напрежение изисква използването на статични методи. Подходящи и някои полу-статични методи, такива като методи за разделяне пръстени сметки капчици максимално мехурчета под налягане и др. С простотата и използваемостта на тези методи дават задоволителни резултати, ако измерванията се извършват така, че образуването на нова повърхност под формата на капчици е достатъчно създаване концентрация на равновесие. В разтвори на повърхностно активни вещества с ниско молекулно тегло равновесни стойности # 963; обикновено се постига за по-малко от една минута; за повърхностно решения по-сложни структури за установяване на равновесие може да отнеме до няколко десетки минути поради бавното дифузията на молекулите. По този начин, за правилното метод избор трябва да се вземат предвид проучванията кинетиката установяват равновесни стойности повърхностното напрежение.
Един от най-простите методи за измерване на повърхностното напрежение на границата "г - г" е метод stalagmometry (метод за преброяване на капки). В него напрежение течност повърхност на граничната повърхност с газ се изчислява чрез следното уравнение:
където s0 - повърхностното напрежение на чист разтворител, n0 и п - брой на чистия разтворител и разтворът капки изтекъл от stalagmometry; r0 и г - плътност и разтвор разтворител.
ъгъл Контакт
Малка капка течност се поставя върху твърда повърхност може да приеме различни форми: или почти сферична, като капка вода върху повърхността на восък или формата на тънък обектив. В първия случай, твърдата повърхност е слабо омокря от течност (не-омокрящи), а вторият - добре навлажнена (овлажнен).
Според броя на фазите, участващи в процеса, има два вида омокрящи:
1) потапяне омокрящ се провежда при напълно потопена твърдо тяло в течност; в такъв случай, омокрящо включва две фази: течност и твърдо вещество;
2) контакт омокрящи потоци, включващи три фази: твърди, течни, газообразни (например, капка течност върху твърда повърхност).
Количествена мярка на процеса на омокряне може да служи като ъгълът, образуван от капка и твърдата повърхност. Този ъгъл се нарича контактния ъгъл и е означен # 952;. значение # 952; може да варира от 0 до 180 °. Големината на ъгъла на контакт се отчита между твърдата повърхност и допирателната към повърхността на спад в точката на контакт на твърди, течни и газообразни фази. Измерване на ъгъла произведен от течност (фиг. 62).
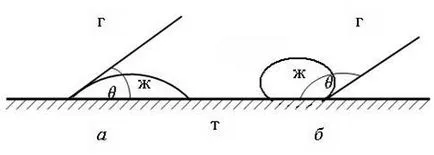
Фиг. 62. Контактните ъгли на омокряне:
и - овлажняващи течност;
б - овлажняващи течности
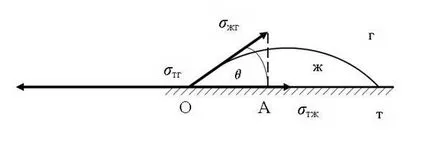
Редът, в който повърхността на течността в този раздел - газ е в контакт с твърда повърхност, се нарича омокрящи периметър. контактен ъгъл # 952;. които при равновесие е установено трифазна система (твърдо вещество - течност - газ), това зависи само от повърхностното напрежение в границите фаза. Ако ние считаме, повърхностното напрежение, както е силата, действаща по допирателна към интерфейса, връзката между ъгъла на контакт и повърхностно напрежение може да се изрази чрез уравнението на Юнг:
и # 963 п. # 963; tzh. # 963; XI и - трите сили, действащи на единица дължина на мократа периметър (Фигура 63). продукт # 963; XI защото # 952; Той представлява вектора проекция # 963; XI върху хоризонталната равнина (Фигура 63, OA сегмент.).
От уравнение (295), че процесът на омокряне може да се контролира чрез промяна на напрежението на системата повърхност. Най-ефективният метод е да се въведе повърхностно активното вещество в течната фаза или разтвори предварителна обработка повърхностно твърдата повърхност. По този начин, не само може да се отрази на размера на намокряне, но също така да доведе до неговата инверсия, че е качествено променят характера на намокряне.
Общият модел в процесите на омокрящи проявява в това, че по-висока полярност от течността, по-слабата си омокрящи свойства: високо полярни мокри живак само някои метали, водни мокри повърхността на много полярни вещества, органични течности (алкохоли, бензен, хексан) овлажнен с почти всяка повърхност.
Повърхностното напрежение на различни твърди вещества, течности и подобни, не е същото, но за твърдите вещества е значително по-голям, отколкото за течности.
Молекулното естеството на твърди вещества, тяхната способност да взаимодействат с вода може да се характеризира с хидрофилност и хидрофобност. Хидрофилен тяло докато е в контакт с вода, и неразтворими в неполярни течни вода (въглеводород) селективно омокря по капка вода. Последните форми с повърхността на техните контактни ъгли в обхвата 0 ° <θ <90°. Гидрофобные тела в тех же условиях избирательно смачиваются углеводородом, и капля воды с их поверхностью образует краевые углы смачивания 90° <θ <180°.
Хидрофобният имота се проявява в това, че взаимодействието между водните молекули и тялото слаба от взаимодействието между самите водните молекули. Хидрофилният имота се характеризира с това, че взаимодействието между водните молекули е по-слаба от взаимодействието между водните молекули и твърдо вещество. В тази връзка, хидрофобни твърди повърхности като противопоставят омокрящи се с вода и е хидрофилни, напротив, то е лесно да се навлажнява.
Фигура 64 показва формата на течни капчици върху твърди повърхности с различна мокрещата способност; от тази фигура се вижда, че на повърхността на минерали е добре намокрена капка течност (вода, масло) тече, докато за слабо омокрящи минерали остава на повърхността, при поддържане на овална форма.
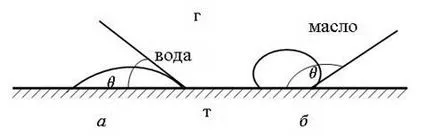
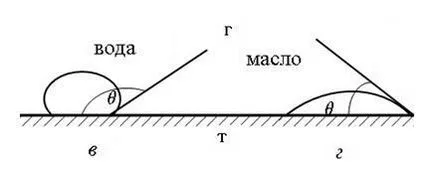
Фиг. 64. формата на течни капчици върху твърди повърхности с различна омокряне:
Различни минерали се характеризират с различни омокряне. По този начин, сулфиди обикновено са хидрофобни и оксиди - са хидрофилни, където степента на хидрофилност или хидрофобност различно. Колкото по-висока омокряемостта на минерала, т.е. повече тя проявява хидрофилни свойства, по-малко флотация активност, и обратно, толкова повече е хидрофобна, толкова по-голям ъгъл на контакт по-естествен и флотационен активност има.
Много високи стойности на контактните ъгли на омокрящи характеристики на минерали: сяра (80 °), талк (70 °), графит (до 60 °), сулфиди различни (до 30-50 °). За окислението на цветни метали, стойностите на контактни ъгли са доста ниски.
Естеството на твърдата повърхност, а оттам и на повърхностното напрежение може да променя и трансформира хидрофилна повърхност в хидрофобен (процес водоотблъскване) а от друга страна, хидрофобна повърхност може да бъде превърнато в хидрофилен (процес хидрофилизация) а чрез покриване на твърда повърхност (минерали) тънък слой вещества ( Фиг. 65).
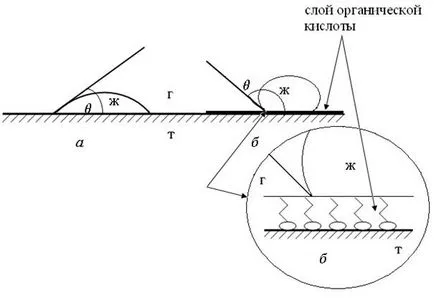
Фиг. 65. Хидроизолация на повърхността:
и - обичайните повърхността на алуминиевата плоча;
б - повърхността на алуминиевата плоча монослой на органичната киселина
По този начин повърхността на алуминиева плоча (фиг. 65 а), при нормални условия на оксид филм покритие Al2 О3. хидрофилни, т.е. добре намокрен с вода (# 952 = 40 °). За хидрофобизиран алуминиева плоча е достатъчно да се покрие с разтвор на органична киселина. молекули киселина, адсорбирани върху повърхността на плоча за оформяне на ориентирани слой, където полярните групи на молекулите са изправени пред повърхността на плочата, докато веригите въглеродни - във въздуха. Както се вижда на фигура 65, б. капка вода върху третираната органична киселина алуминиева плоча образува контактни ъгли> 90 °.
Ъглите се измерват лесно експериментално. За тази цел оптични средства, чрез които капчицата очаква на екран или ъгъл се определя директно от оптичното изображение.
омокрящи явление е тясно свързано с действието на сближаване и адхезионни сили.
Ø хомогенни кохезивни наречени адхезионни молекули, атоми или йони, които включват всички видове междумолекулна и interatomic привличане в една фаза.
Кохезионната определя наличието на вещества в кондензира (течни и твърди) състояние. Тези условия са високо кохезивни. Газообразни вещества имат ниска сближаване.
О, адхезия (слепване) - е молекулното привличане между повърхностите на две различни контакт твърди или течни фази.
Адхезия е причина за свързване на две различни фази се дължи на действието на физични или химични междумолекулни сили.
Количествено сближаване и адхезия характеризира количеството на работата и работят kogeziiAs adgeziiAa.
Работата на сближаване (фиг. 66, а) е равна на енергията, която трябва да се изразходват, за да се прекъсне кохезионни сили между молекулите на дадена фаза. Числово работа на сближаване (J / т2) е равна на два пъти повърхностното напрежение на:
Работата на сцепление (Фигура 66, б.) - е работата изразходват в един фазово разделяне на молекули от молекули друга фаза.
Фиг. 66. диаграма, илюстрираща концепциите на сближаване (а) и адхезия (б) в равнина А
Големината на работата на сцепление може да се види от силата на лепило връзка (адхезия сила, свързване). адхезия работа изразена в единици на повърхностното напрежение (J / т2). Адхезия е съпроводено с намаляване на повърхността на енергия. Това означава, че при комбинирането на различните фази на Гибс енергия на системата се намалява с размера на работата на сцепление:
Адхезията на течността, един вид адхезивни взаимодействия, реализиран в течен контакт с твърда повърхност. Ако фаза 1 - газообразен, 2 - течност, и 3 - Твърдо вещество (. Фигура 67), след това се прилага за адхезията на флуид към уравнението на твърда фаза за адхезията може да бъде представена както следва:
Полученото уравнение Дюпре (299) отразява закона за запазване на енергията за сцепление.
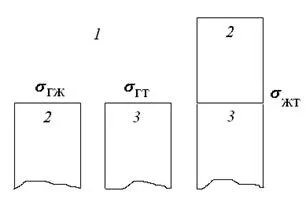
Фиг. 67. Определяне на връзката между ефективността адхезия и повърхностни напрежения на взаимодействащите компоненти
С помощта на уравнението на Юнг (295), сцеплението работата на течността може да се запише по следния начин:
Феномените на сближаване и адхезия играе важна роля в много промишлени процеси, по-специално в областта на технологиите на наркотици. Сближаване и адхезия засегне взаимодействието на компонентите в сложни форми за дозиране, разпадането на таблетките, силата на покритие на черупките, за процеси на разтваряне и в крайна сметка на ефективността на терапевтичното действие. Адхезионни явления въз основа на действието на лепила и свързващи вещества.
омокрящи явление засяга хода на много процеси в природата и технологии, както е началния етап на взаимодействието на течности с твърди вещества.