Механизмът на образуване на връзка
Неметални атом се външните електрони от метал атом, и се превръща в аниони (отрицателно зареден йон). Металният атом губи електрони и се превръща в катион (положителен йон). Йоните са обвързани с електростатични сили. Налице е пълна възвръщаемост (приемане) на електроните валентните, има не се наблюдава припокриване на споделяне на облак от електрони.
1. йонни съединения имат висока точка на топене и ниска летливост. Това явление се дължи на силно електростатично привличане между катионите и анионите на съединението. По този начин, в кристала на цезиев хлорид, цезиев йон е заобиколен от осем на хлорни йони, присъстващи на късото разстояние от него, и всеки хлорен йон - осем цезиеви йони.
2. йонни съединения обикновено имат ниска електрическа проводимост в кристално състояние, тъй като йони в кристалната решетка, не са способни на транслационно движение. стопилки йони като способността печалба, в резултат на йонен топи съединения основание на електрически ток.
3. йонийски кристали са трудни, но крехки. Твърдостта на йонни съединения се дължи на липсата на посоки, в който кристалната решетка може да се отделят за, като в случай на графит кристал. Ронливост на таблетките йонни кристали се дължи на факта, че дори леко деформиране на решетката са придружени от сближаване като заредени йони, при което съотношението на отблъскващи и сили на привличане е счупени и кристално паузи.
4. йонни съединения обикновено значително разтворими в полярни разтворители. Полярни разтворители се характеризират с високи стойности на диелектрична константа, която е свързана с енергията взаимодействие на зарежда уравнение две частици.
12. Метален връзка: механизъм формация, характеристики за комуникация.
Ме-тал-дали-Che-ЛИК комуникация - тип комуникация в ме-Tal-кристали и техните SPLA острови между атомите-ma-ми или йон-ми ме-тал-на улова и не-виж-Tel още неговото предаване-HN-E елек-Пр-на-ми (електро-Tron Ним газ) е кри-Th-са-D-XYZ Шет-ке.
Механизъм на-ра-зо-ва-нияма-тал-ли-ти-ТА svyaziso сто от това следва да не се прави-ти до сега: ме-тал-риболов атомите на га разтваря в Rouge електрон-WIDE TPO нас, и Neko най-ръжта са предварително Вера е проводник-по-Ся в по-ло-жа Тел но за манастира съпруги мащаб йони. Ото-rvav-ши-I-Ся-атома от Mov елек-Отстраняване-HN-на-а-Б но Тел предаване NE-не-ре-ме-проводящ разтваря Xia между момента на участника--ши MI-ето на г-жа-Tel-HN-ми-ми йон ме-тал-риболов. Между тях ва-STI-ва ми количка-нито-ка-а ме-тал-ли-ти-ЛИК връзка, R. F. Elec-Пр-HN като Цзе-мъже-ти-Ру-разтваря в ето -zhi-Тел мащаб йони в мен-тал-дали-Che-ТА повторно Шет-Кио.
Черти. За всички метали се характеризира с електрическа и топлинна проводимост, пластичност, метален блясък, обикновено в сив цвят и непрозрачност.
13. ковалентна връзка: механизъм формация, характеристики за комуникация.
Ковалентни връзки - химичната връзка между два атома, социализация се случва, когато електрони, принадлежащи към тези атоми.
В случай на неполярен ковалентна връзка електронен облак, образуван от общата двойка електрони, или електронна комуникация облака разпределени симетрично в пространството по отношение на ядрата на двата атома. Примерите включват двуатомни молекули, състоящи се от атома на един елемент: Н2. Cl 2. O2. N2. F2 и др., При което електронната двойка еднакво принадлежи към двата атома.
В случай на облак полярен ковалентна връзка електронни съобщения изместен атома с голяма относителна Електроотрицателност. Един пример е молекулата на летливи неорганични съединения: HCl, Н2 О, Н2 S, NH3 и др.
ковалентна механизъм образуване на връзка.
· Exchange - участват в свързване на единични електрони атомна орбитала, т.е. всеки атом осигурява за общо ползване на един електрон.
· Донор-акцептор - образуване на връзка се дължи на електронна двойка донорен атом и свободни орбитите на акцепторни атома.
· Saturability - определяне стехиометрия (количествен състав), молекулни химически съединения.
Тази функция се състои в това, че всеки атом да прикачвате само определен брой други атоми. По този начин, като цяло, прости газообразни вещества се състоят от атоми 2: О2. Cl 2. N2, и т.н.
· Ориентация - определяне на пространствената структура на молекула (молекула формата) на. Насоченост зависи от: 1) - броят на атомите в молекулата; 2) - вида на взаимодействие на електрона облаци.
Молекулите са от следните форми:
· Триъгълен - BCI3. AICI3 (равнина);
С прости вещества двуатомни молекули (Н2. O2. Cl2 т.н.) електронни двойки, които образуват ковалентни връзки принадлежат еднакво за двете атоми и следователно са по средата между центровете им, т.е. общата електронен облак симетрично. Съобщение в този случай се нарича неполярен (ковалентно).
14. Хибридизацията на атомна орбитала.
Орбитали Хибридизация - процес на смесване на различни хипотетичен (а, р, D, F) орбитали на централната атом на полиатомен молекула, без поява на идентични орбитали, които са еквивалентни на техните характеристики.
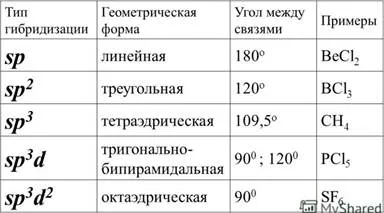
15. Структурата на комплексни съединения. Разпадането на комплексните съединения. Дисоциационната константа на комплексни съединения.
Комплексно съединение - частици образуват положително заредени метални йони могат да бъдат заобиколени от анионите или неутрални молекули.