Лекция органика
Лекция 2. Органични вещества. протеини
На rganicheskie съединение са средно 20-30% от масата на живи клетки на тялото. Те включват биологични полимери - протеини, нуклеинови киселини и полизахариди, както и мазнини и редица нискомолекулни органични вещества - аминокиселини, прости захари, нуклеотиди и т.н. Полимери - комплекс с разклонена или линейна молекула, хидролиза разлагат до мономери. Ако полимера се състои от един вид мономери, полимерът се нарича хомо. Ако съставът на полимерната молекула съдържа различни мономери - това е хетерополимер. Ако групата на различни мономери в полимерната молекула повтаря (A, B, C, A, B, C, A, B, C) - е редовен хетерополимер. ако няма повторение на определена група от мономери - хетеро неправилни.
Клетки от органични вещества в броя и стойността на първо място са протеини. Протеини. или протеини (от гръцката Protos -. Първо, основните) - макромолекулен хетерополимери, органични вещества и се разлагат на аминокиселини на хидролиза. Стойността на протеин е толкова висока, че информацията за протеините, включени в двата най-популярни определението на живота: "Животът е начина на съществуване на белтъчните тела, съществен елемент от които е постоянен обмен на вещества с околния външен характер, и с прекратяването на този метаболизъм престава и животът, който води разграждащи протеин "(Engels). "Дневна органи, съществуващи в света, са отворени, саморегулираща и самостоятелно възпроизвеждане система, изградена от биополимери - протеини и нуклеинови киселини" (M.V.Volkenshteyn).
Простият структурата на протеини (състоящи се само от аминокиселини) включва въглерод, водород, азот, кислород и сяра. Част протеини (сложни протеини) образува комплекси с други молекули, съдържащи фосфор, желязо, цинк и мед - са сложни протеини, съдържащи аминокиселини, в допълнение също непротеинови - протезна група. Тя може да бъде представена от метални йони (металопротеините - хемоглобин), въглехидрати (гликопротеини), липиди (липопротеинови), нуклеинови киселини (нуклеопротеини).
Протеините са нередовни хетерополимери. който мономерите са α-аминокиселини. Клетките и тъканите се намират над 170 различни аминокиселини, но само 20 а-амино киселини, включени в протеина. В зависимост от това дали аминокиселината синтезира в тялото, се отличават: незаменими аминокиселини - десет амино киселина, синтезирано в тялото и незаменими аминокиселини - аминокиселини, които не се синтезират в организма. Незаменими аминокиселини трябва да се приема с храна.
В зависимост от състава на аминокиселината на протеини са пълни. ако те съдържат целия набор от незаменими аминокиселини и по-ниско. Ако някоя от незаменими аминокиселини в състава не.
Общата формула на аминокиселини е показано на фиг. Всички α-амино киселина при α въглероден атом включват водороден атом, карбоксилна група (-СООН) и амино (-NH2). В останалата част от молекулата е радикал.
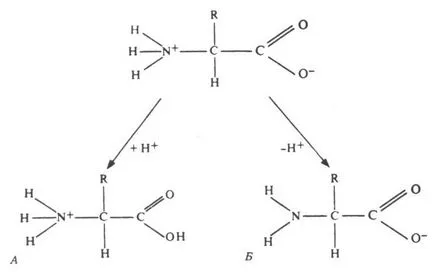
Фиг. 255. Амфотерните свойства на аминокиселини при различни рН.
minogruppa лесно отдава водородни йони, т.е. Тя показва основните свойства. Карбоксилната група е лесно дава водороден йон - киселина проявява свойства. Аминокиселините са амфотерни съединения, тъй като те са в разтвор може да действа както като киселини и основи. В водни разтвори, аминокиселини съществуват в различни йонни форми. Това зависи от рН и при какви аминокиселина: неутрална, кисела или алкална.
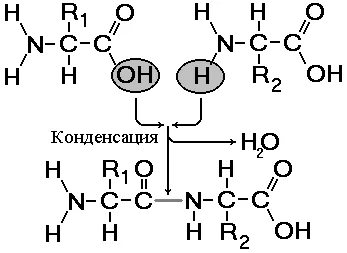
Фиг. 256. Получаването на дипептида.
В зависимост от броя на аминогрупи и карбоксилни групи в амино състав киселина, разграничат неутрални аминокиселини, имащи една карбоксилна група и една амино група на базични амино киселини, имащи радикал друга амино киселина, и амино киселини с по-карбоксилна група в радикал.
Пептиди - органични вещества, състоящи се от малък брой аминокиселинни остатъци, свързани чрез пептидна връзка. Образуването на пептиди резултати от реакцията на кондензиране на аминокиселини (фиг.).
В реакцията на амино групата на една аминокиселина с карбоксилна група на друга, между тях има ковалентни азот-въглеродна връзка, която се нарича пептид. В зависимост от броя на аминокиселинни остатъци, съдържащи пептида разграничи дипептиди, трипептиди, тетрапептиди, и т.н. образуване на пептидна връзка може да се повтори многократно. Това води до образуването на полипептиди. Ако полипептидът се състои от голям брой аминокиселинни остатъци, той вече се нарича протеин. В единия край на молекулата е свободна амино група (наречен N-края), и от друга - на свободна карбоксилна група (наречен С-края).
Структурата на протеиновата молекула.
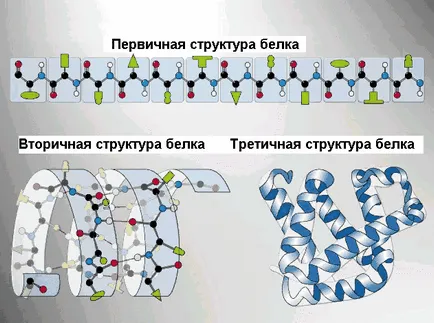
Изпълнение на някои протеини специфични функции зависят от пространствената конфигурация на молекулите в допълнение, клетката енергично неблагоприятно поддържа протеини в разширена форма, както верига, така полипептидни вериги са били показани полагане придобиване определена триизмерна структура или структура. Има 4 нива на пространствената организация на протеини.
Основната структура на протеина - последователност от аминокиселинни остатъци място в полипептидната верига на протеиновата молекула компонент. Комуникацията между аминокиселини - пептид.
слят протеин молекула се състои от остатъци само 10 аминокиселини, броят на теоретично възможни варианти протеинови молекули, различаващи се по процедура аминокиселина разделяне - 20 10. протеини, получени от живи организми, са образувани от стотици и хиляди понякога аминокиселинни остатъци.
При хората, наблюдавано порядъка на десетки хиляди различни протеини, които са различни един от друг и от протеини от други организми.
Това е първичната структура на молекулата на протеин се определя свойствата на протеина и неговата пространствена конфигурация. Смяна само една аминокиселина с друга в полипептидната верига води до промяна в свойствата и функцията на протеина. Например, заместването в бета-субединица на хемоглобин шести глутаминова аминокиселина към валин причинява молекулата на хемоглобина като цяло е в състояние да изпълнява своята основна функция - транспорта на кислород (в такива случаи, заболяването се развива в хора - сърповидно-клетъчна анемия).
Първият белтък, чиято аминокиселинна последователност е идентифицирана, става хормона инсулин. Изследванията са проведени в F.Sengerom университета в Кеймбридж 1944-1954. Установено е, че инсулин молекула се състои от две полипептидни вериги (21 и 30 аминокиселинни остатъка), проведена една до друга чрез дисулфидни мостове. За своя труд F.Senger е удостоен с Нобелова награда.
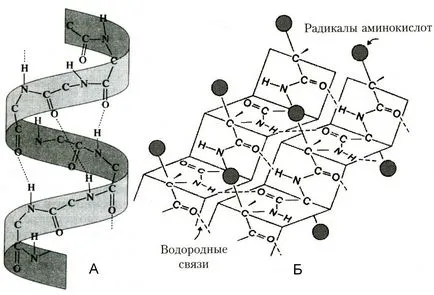
Фиг. Вторични белтъчни структури
торичност структура - подредена сгъване на полипептидната верига в α-спиралата (форма опъната пружина) и β-struktra (нагънат слой). В α- спирала NH-група на амино киселинния остатък взаимодейства с СО-група на четвъртата остатък от него. Почти всички "СО" и "NH-група" участва в образуването на водородни връзки. Те са по-слаби от пептида, но повтаря много пъти, тази конфигурация дава стабилност и твърдост. съществуват протеини на нивото на вторична структура: фиброин (коприна, паяк платна), кератин (коса, нокти), колаген (сухожилие).
Сгънати слой (синоним β-struktra) се образува, когато сегментите на полипептидни вериги, разположени паралелно или антипаралелен един до друг в един слой. Това представлява фигура, наподобяваща листа, сгънати духало.
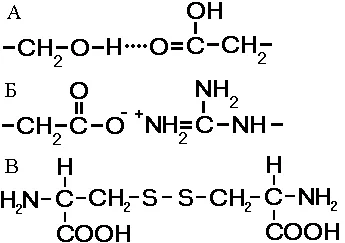
Фиг. Комуникация, стабилизиране третичната структура:
А - водород, В - йон, The - дисулфид.
retichnaya структура - полагане полипептидни вериги в глобули. възниква в резултат на химически връзки (водород, йонни, дисулфидни) и за установяване на хидрофобни взаимодействия между радикали на амино киселинни остатъци. Основната роля в образуването на третични структури играят хидрофилни-хидрофобни взаимодействия. Във воден разтвор хидрофобните радикали са склонни да се скрие от водата глобули са групирани във вътрешността, а хидрофилните остатъци чрез хидратиране (реакцията с вода диполи) са склонни да бъдат на повърхността на молекулата.
Някои протеин третична структура стабилизира чрез дисулфидни ковалентни връзки, възникващи между два серни атоми на цистеинови остатъци. На нивото на третична структура, има ензими, антитела, някои хормони. Формата на молекулата отличава глобуларни протеини и влакнест. Ако фибриларни протеини работят предимно поддържаща функция, на глобуларни протеини са разтворими и изпълняват различни функции в цитоплазмата или вътрешната среда на организма.
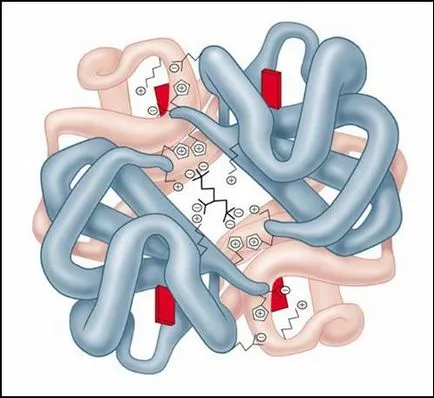
Фиг. молекулата на хемоглобина
etvertichnaya структура е типично за сложни протеини, които молекули са образувани от две или повече глобули. Субединиците се провеждат предимно в молекулата посредством нековалентни връзки, предимно водород и хидрофобен.
Най изследван протеин като кватернерна структура е хемоглобин. Тя се формира от две -субединици (141 аминокиселинни остатъци) и две -субединици (146 аминокиселинни остатъци) .С всяка субединица свързан хем молекула, съдържаща желязо.
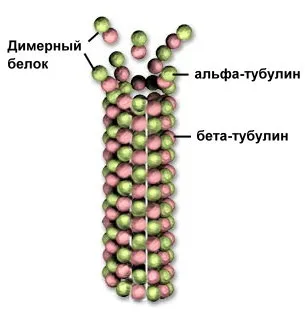
Фиг. Микротубулите от тубулин
крака протеини с кватернерна структура заемат междинно положение между молекули и клетъчни органели - например микротубулите цитоскелет протеин, съставен от тубулин. състояща се от две субединици. Тръбата е удължен до присъединяването на димера до края.
Ако по някаква причина пространствената структура на протеина се отклонява от нормалната протеин не може да изпълнява функциите си
Аминокиселинният състав, структурата на молекулата на протеин се определят нейните свойства. Протеини комбинират основни и киселинни свойства, определени от амино радикали, по-киселинни аминокиселини в протеин, толкова по-силно изразени неговите киселинни свойства. Способността за свързване и дава + Н определи буфериращи свойства на протеини, един от най-мощните буфери - хемоглобин в червените кръвни клетки, поддържащ рН на кръвта на постоянно ниво.
Има разтворими протеини (фибриноген), там са неразтворими. извършване на механични функции (фиброин, кератин, колаген).
Всички активни протеини химически (ензими), е химически неактивни. устойчиви на различни условия на околната среда и изключително нестабилна.
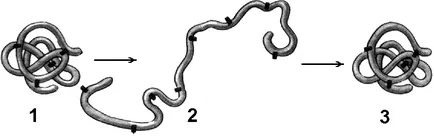
Фиг. Денатури и връщане на природата на протеина:
1 - третична структура на молекулата на протеин; 2 - денатуриран протеин; 3 - възстановяване на третичната структура по време на ренатурация.
Външни фактори за разширение (топлина, ултравиолетова радиация, тежки метали и техните соли, промени в рН, радиация, дехидратация) може да доведе до нарушаване на структурната организация на протеиновите молекули. Загубата на триизмерната структура на протеина, присъщи на молекулата, без унищожаване на първична структура nazyvayutdenaturatsiey.
Причината е, денатурационния отделянето, определен стабилизиране на структурата на протеина. Първоначално разкъсан най-слабото връзка, а по-строги условия и по-силен. Следователно кватернерен първия изгуби, вторична и третична структура. Промени в пространствената конфигурация води до промяна в свойствата на протеина и, като следствие, прави невъзможно да се изпълни своята биологична функция, присъща на протеини.
Ако денатурация не е придружено от разрушаване на първичната структура, може да бъде обратимо. в този случай самолечение характеристика на протеин конформация. Тази денатурация изложени, например, мембрана рецепторни протеини. Процесът на възстановяване след денатуриране на протеин структура, наречена връщане на природата. Ако възстановяването на пространствената конфигурация на протеина не е възможно, денатурирането се нарича необратим. Унищожаване на основната протеинова структура, наречена разграждане.
Поради сложността, разнообразието от форми и състав, протеини играят важна роля в клетките на организма, както и живота като цяло. Техните разнообразни функции.
Човечеството навлезе в нова ера на неговото съществуване, когато потенциалната способност на химични, биологични и физически означава, че той създава въздействие върху местообитанието става сравнима със силите на природата.
Функционално биохимия (връзка между структурата на вещества и техните модификация процеси, от една страна, и функцията на органели, клетки, тъкани и органи, съдържащи тези вещества.
Почвата се формира на повърхността на земята в тази част на биосферата където блокировка и проникват един друг литосферата, хидросферата и атмосфера, и където плътността на жива материя планета особено голямо.
Първата систематична справка кратка научното ръководство на човешкото еко-логия, която включва около 2 хиляди души. Термини и определения в целия обем на въпроси, свързани с характеристиките на екосистемите "човек-природа с-да", "човек-продукция."
Първата систематична справка кратка научното ръководство на човешкото еко-логия, която включва около 2 хиляди души. Термини и определения в целия обем на въпроси, свързани с характеристиките на екосистемите "човек-природа с-да", "човек-продукция."