Кислород хлор съединение
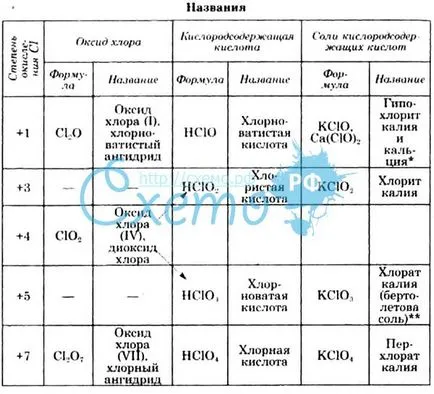
Хлоро получава 4 оксикиселини: hlornotistuyu хлорид, хлорни и перхлорна.
Hlornotistaya киселина (HClO) се образува чрез реакция на хлор с вода, и неговите соли със силни минерални киселини. Той принадлежи към слаби киселини, то е много нестабилна. Съставът на реакционните продукти на неговото разлагане зависи от условията. Когато силна светлина хипохлориста киселина в присъствието на разтвор на редуциращ агент и удължено заставане се разлага да освободи атомен кислород:
В присъствието на дехидратиращи агенти образува хлор оксид (I):
На Cl2 анхидрид може да се разглежда като хипохлориста киселина. При нагряване на хипохлориста киселина се разлага до образуване на 2-киселина - солна киселина и хлорна:
3 HClO + HCl = 2 NSlO3.
Следователно, когато взаимодействието на хлор с горещ алкален разтвор не се образува сол на солна и хипохлориста и солна киселина и хлорни киселини:
Солите на хипохлориста киселина - хипохлорити - много силни окислители. Те се образуват чрез реакция на хлор с алкален на студено. Едновременно соли, образувани със солна киселина. От такива смеси на най-широко използваните белина и zhavelevoy вода.
Хлорна киселина (NSlO3) е оформен под действието на нейните соли - хлорати - сярна киселина. Тази киселина е много нестабилна, много силен окислител. Това може да съществува само в разредени разтвори.
Изпаряването NSlO3 разтвор при ниска температура под вакуум може да се получи вискозен разтвор, съдържащ 40% перхлорна киселина. При по-високо съдържание на разтвора киселина се разлага с експлозията.
Разлагане с експлозия настъпва при по-ниска концентрация в присъствието на редуциращи агенти. В разредени разтвори на хлорна киселина проявява окислителни свойства и реакции протичат доста лесно:
сол хлорна киселина, образувана по време на електролиза на разтвори на хлориди в отсъствието на диафрагма между катодните и анодните пространства, а също и когато се разтваря в горещ хлор алкален разтвор, както е показано по-горе. Създадена чрез електролиза на калиев хлорат (bertoletova сол) слабо разтворим във вода и се получава бяла утайка се отделя лесно от други соли. Като киселина, хлорат - доста силни окислители:
Хлорати се използват за производството на взривни вещества, както и за производство на кислород ин витро и перхлорна киселина соли - перхлорати. При нагряване на калиев хлорат в присъствието на манганов диоксид (МпО 2), която играе ролята на катализатор, кислород се освобождава. Ако топлината на калиев хлорат без катализатор, той се разлага до образуване на калиеви соли на солна киселина и перхлорна:
При обработка перхлорати концентрирана сярна киселина перхлорна киселина, могат да се получат:
Това е най-силната киселина. Това е най-стабилен от всички кислород-съдържащи киселини с хлор, обаче, безводен киселина при загряване, разклащане или в контакт с редуциращи средства могат да се разлага с експлозията. Разрежда разтвори на хлорна киселина е много стабилна и безопасна при работа. калиев хлорат, рубидий, цезий, амоняк, органични основи и най-слабо разтворим във вода.
В промишлеността, калиев перхлорат се получава чрез електролитно окисляване на калиев хлорат:
2 + Н + 2 е - = Н 2 ↑ (катода);
SlO3 - - 2 е - + Н 2О = SlO4 - + 2 + Н (анод).
Хлорист киселина (NSlO2), образуван от действието на концентрирана сярна киселина, хлорити на алкални метали, които се получават като междинни съединения при електролиза на разтвори на алкални хлорид в отсъствието на диафрагма между катодните и анодните пространства. Това е слаб, нестабилна киселина е много силен окислител при киселинни условия. Чрез взаимодействие със солна киселина освободен хлор:
Натриев хлорид се използва за производство на хлорен диоксид за дезинфекция на вода, както и избелване агент.
Перхлорна или избелване на прах, вар (SaOSl2) или СаСЬ (СЮ), образувани чрез реакция на хлор с прахообразен калциев хидроксид - Pushenko:
Под влияние на газ въглероден двуокис, съдържащ се във въздуха, се разлага да освободи хлор:
Bleach се използва като белина и дезинфектант.