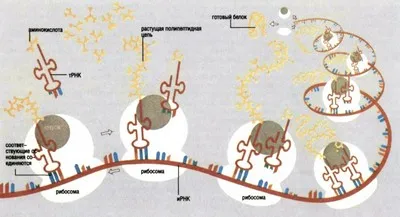
Както се появява протеинова синтеза
Всяка област на науката има своя собствена "синя птица"; Кибернетика мечта на "мислене" машини, физика - на контролирания термоядрен реакции, химици - синтеза на "живата материя" - протеин. Синтеза на протеини в продължение на много години са били предмет на научно-фантастични романи, символ на бъдещата способност на химия. Това обяснява и огромната роля, която принадлежи към протеин в света на живите, и трудностите, които неизбежно възникват преди всеки смелчага, който се осмели "да се прибират" на отделните аминокиселини на протеин сложна мозайка. И дори не най-много протеин и пептид само.
Разликата между протеини и пептиди не само терминология, въпреки че молекулните вериги на двете групи се състоят от аминокиселинни остатъци. В един момент, броят на комбинация в качеството: пептидна верига - първична структура - придобива способността да се прибират в спирала и серпентините, които са вторични и третични структури характерни дори за жива материя. И тогава тя се превръща в пептид протеин. Ясно граница не съществува тук - не може да се постави на демаркация марка на полимерната верига: досега - пептид от тук - протеин. Но това е известно, например, че adranokortikotropny хормон, състояща се от остатъци 39 аминокиселинни - е полипептиден хормон и инсулин, състояща се от 51 остатъци под формата на две вериги - това е протеин. Най-простият, но все пак бяло.
Методът на амино киселини в пептид съединението е открит в началото на миналия век от германския химик Emilem Fisherom. Но за дълго време след това химици не може сериозно да съзерцават не само синтеза на протеин или 39-мерен пептиди, но дори значително по-къси вериги.
Процесът на протеиновия синтез
За да се свържат две аминокиселини, е необходимо да се преодолее много трудности. Всяка аминокиселина, като две изправени Янус има две химична единица: карбоксилна киселинна група в единия край и основна амино група - в друга. Ако една амино киселина от карбоксилен вземат ОН група и амино група на друг - водороден атом, след това така получените две аминокиселинни остатъци на пептидната връзка могат да се свързват един с друг, и в резултат има простата на пептиди - дипептид. И люспи от молекула вода. Повтарянето на тази операция, е възможно да се увеличи дължината на пептида.
Все пак, това изглежда на пръв поглед, една проста операция е практически трудно да се прилагат: аминокиселините са много склонни да се свързват един с друг. Ние трябва да ги активирате химически и "затопли" един от краищата на веригата (обикновено карбоксилни) и провеждане на реакцията, при стриктно спазване на необходимите условия. Но това не е всичко: Втората трудност се състои в това, че комуникират помежду си не са останките от различни аминокиселини, но двете молекули на същата киселина. В този случай, структурата на синтезирания пептид трябва да бъде различен от желания. Освен това, всяка аминокиселина може да не два, а няколко "ахилесова пръст '- страничен реактивни групи, способни на свързване аминокиселинни остатъци.
За да се предотврати разпадането на реакцията при посочената пътека, е необходимо да се прикрие фалшива мишена - "печат" за времетраенето на реакцията се осъществява всички реактивни амино група, с изключение на един, да се присъединят към тях, така наречената защитна група. Ако това не е направено, след това целта ще бъде да расте не само в двата края, но също така и странично, и аминокиселини няма да могат да се свързват в определена последователност. И всъщност това е смисълът на цялата насочена синтеза.
Но по този начин да се отърве от един проблемни химици се сблъскват с друг: защитните групи, след синтеза за премахване. По време на Фишер като се използва "защита" групи, които се отцепва чрез хидролиза. Обаче, реакцията на хидролиза обикновено е твърде силен "удар" към получения пептид: едва построен му "дизайн" се разпада, веднага след като се отстранява от "скеле" - защитни групи. Само през 1932 г., Fisher М. Bergmann студент намери изход от тази ситуация: той предложи да се защитят аминокиселини карбобензокси аминокиселини, които могат да бъдат отстранени, без увреждане на пептидната верига.
Синтез на аминокиселини на протеина
През следващите години той предложи редица т.нар меки методи "шиене" на аминокиселини един с друг. Въпреки това, в действителност те са само една вариация по темата за метода на Фишер. Вариации в които е понякога е трудно да улови оригиналната мелодия. Но принципът е останал същият. И едни и същи трудности са свързани със защитата на уязвимите групи. За преодоляване на тези трудности е трябвало да плащат все повече етапа на реакция: една елементарна събитие - свързването на две аминокиселини - разпаднаха на четири етапа. И всяка допълнителна стъпка - е неизбежна загуби.
Дори ако се приеме, че всяка стъпка е полезен добив 80% (което е добър добив), след това през четирите етапа на 80% от "стопилка" до 40%. И това е само синтеза на дипептид! Ако аминокиселини ще бъдат 8? И ако 51 е инсулин? Към тази сложност, свързана с наличието на два оптични "огледало" форма молекули на аминокиселини, от които в реакцията трябва само един, Priplyusuet проблеми за разделяне на получената пептиди от продукти, особено в случаите, когато те са еднакво разтворими. Какво се случва в размер на: Път за никъде?
Въпреки тези трудности не спряха химици. Преследването на "синята птица", продължи. През 1954 г. е първият синтезира биологично активни полипептиди хормони - вазопресин и окситоцин. Те бяха осем аминокиселини. През 1963 се синтезира 39-членен полипептид АСТН - адренокортикотропен хормон. И накрая, американски химици, Германия и Китай първи синтезирани протеини - хормона инсулин на.
Като е така, читателят ще кажа, по трудния начин, се оказва, не е водена никъде, а не само навсякъде, но да реализира мечтата на много поколения химици! Това е важно събитие! Вярно е, че това е - вододел събитие. Но нека го оцени разумно, който се отказва от сензации, удивителни знаци и излишни емоции.
Няма спор: синтеза на инсулин - огромна победа химици. Това е един огромен, титаничен труд, достоен за всички възхищение. Но в същото егото, всъщност, и на тавана на старите химия полипептиди. Това е победа на ръба на поражението.
Синтеза на протеини и инсулин
инсулин 51 аминокиселини. За да ги свърже в правилната последователност, химици, необходими за да прекарат 223 отговора. Когато, три години след началото на първата от която е приключила миналата, добивът е по-малко от една стотна от процента. Три години, 223 етапи, една стотна от процента - са съгласни, че победата е чисто символичен. Да се говори за практическото прилагане на този метод е много трудно: твърде големи, свързани с разходите за реализация. Но в крайна сметка това не е за синтеза на ценни реликви от славата на органичната химия и наличието на основни лекарства, което се изисква хиляди хора по целия свят. Така класически метод за синтеза на полипептиди изчерпани в началото, най-простият протеин. Следователно, "Синята птица" отново избягал от ръцете на химиците?
Нов метод протеиновия синтез
Основната идея на новия метод е, че растящата пептидна верига, която се използва, за да се остави на неорганизираното движение на разтвора, сега е вързана в единия край към твърда опора - като че ли те са били принудени да се закотви в разтвора. Murrayfield се твърда смола и активни групи "връзка" за край карбонил от първите събира в аминокиселинен пептид. Реакциите бяха в рамките на отделните частици смола. В "Лабиринтът" нейните молекули появява за първи път на първите кълнове на бъдещата кратък пептид. След това, в съд въвеждане на втората амино киселина, нейните молекули се свързват с тяхната карбонил завършва със свободна амино края на "свързани" аминокиселини, и частиците нарастват друг "етаж" на бъдещата "сградата" на пептида. Така, стъпка по стъпка, постепенно изграждане на целия пептид-смола.
Новият метод има очевидни предимства: на първо място е решен проблемът за разделяне на отпадъци след присъединяването на всеки редовни аминокиселини - тези продукти са лесно измити и пептидът остава зашит към перли смола. В същото време се избягва проблемите на разтворимост зараждащи пептиди - един от основните вредители на стария метод; преди те често се утаяват на практика престава да участва в процеса на растеж. Пептиди, "премахване" след синтез с твърда подложка, получен почти всички от същия размер и структура, във всеки случай, промяната в структурата е по-малък, отколкото при класическия метод. И съответно по-голямо количество полезна. С този метод на синтез на пептиди - труден, синтез отнема време - лесно податлив на автоматизация.
Murrayfield изградена прост механизъм, който от своя страна е дадена програма извършва всички операции, необходими - подаване на реагентите, смесване, изливане, измиване, отмерена доза, добавянето на нова порция и така нататък. Ако старият метод за съединяване на една аминокиселина трябваше да завие на 2-3 дни, за Murrayfield на машината ви, заедно един ден 5 аминокиселини. Разликата - 15 пъти.
Какви са трудностите на протеиновия синтез
метод Murrayfield нарича твърда фаза, или разнородни, веднага е приета от химици по цял свят. Въпреки това, след като за кратко време стана ясно, че нов метод заедно с основните предимства и има някои сериозни недостатъци.