изоформи на лактат дехидрогеназа
Причините, водещи до увеличаване на броя на ензими в кръвта
Ензимите на кръвната плазма могат да бъдат разделени на 2 групи. Първо, сравнително малка група от ензими активно секретира в кръвната плазма на някои органи. Например, черния дроб синтезира неактивни прекурсори на ензими съсирване. Вторият включва голяма група от ензими, освободени от клетките по време на тяхното нормално функциониране. Обикновено, тези ензими изпълняват своята функция в клетката и нямат физиологично значение на плазма. В един здрав човек активността на тези ензими в плазмата достатъчно ниски и постоянни, тъй като нивата на съотношение постоянно отделяне на клетките и техните проценти унищожаване.
В много заболявания е увреждане на клетките и тяхното съдържание, включително ензими, които са освободени в кръвта. Причините за причиняване освобождаването на вътреклетъчни съдържание в кръвта, носят нарушение на клетъчната мембрана пропускливост на (възпалителни процеси), или нарушават целостта на клетката (некроза). Определяне на кръв активност на някои ензими е добре установено в биохимични лаборатории, които се използват за диагностициране на болест на сърцето, черния дроб, скелетната мускулатура и други тъкани. Степента на ензимната активност в плазмата корелира със степента на увреждане на клетките.
За enzimodiagnostiki са важни знания на субклетъчна локализация на ензими. Така, появата на плазмени кръвни ензими, имащи само цитозолен локализацията, показателно за възпалителния процес; откриване на митохондриални или ядрени ензими може да се говори за по-дълбоките повредят клетките, като например некроза.
Въпреки това, увеличаване на концентрацията на ензими е не винаги е свързано с увреждане на тъканите. Когато прекомерна клетъчна пролиферация, като onkoproliferativnyh процеси при повишена скорост на синтез на някои ензими в клетки или нарушена клирънс (способност vpyuditsya бъбрек) се наблюдава увеличение в концентрацията на някои ензими кръв. Лекарите трябва да имат предвид, че нормалните стойности на активността на ензима в кръвта на деца и бременни жени да се различават от тези, характерни за здрави възрастни.
Ензими, които катализират същата химическа реакция, но се различават в първичната структура на протеина, наречени изоензими или изоензими. Те катализира от същия тип на реакции с по същество същия механизъм, но се различават един от друг кинетични параметри, условия за активиране, характеристики поради апоензим и коензим.
Nature вид на изоензими варира, но най-често се дължи на различията в структурата на гените, кодиращи тези изоензими. Съответно, изоензимите се различават в тяхната първична структура на молекулата на протеин и, съответно, от физико-химични свойства. На разлики в физико-химични свойства, базирани методи за определяне изоензими.
В своята структура изоензими са предимно олигомерни протеини. И един или друг плат главно синтезира някои видове протомер. В резултат на това някои комбинации от тези протомери образувани ензими с различна структура - изомерна форма. Откриване на изозим специфични ензимни форми позволява да се използват за диагностика.
Гликогенфосфорилазен. Допълнителни ензимни и изозим маркери в диагностицирането на инфаркт на миокарда клинични биохимици определят неговата активност и GF GF-BB изоензим. GF - цитозолен ензим, който катализира разцепването на глюкоза в клетката от гликоген.
В човешки тъкани, има три изоензим GF: GF-LL в черния дроб, GF-ММ в миоцити и SP-BB в мозъчната тъкан. В човешки миокард съвременните BB изоензимите- GF и GF-ММ, миоцити в скелетната мускулатура - само на ГФ-ММ. GP-BB - най-чувствителен тест за диагностициране на инфаркт на миокарда в първите 3-4 часа след атака на ангина пекторис. Според диагностичната чувствителност в ранните часове на определение GF активност може да се сравнява само с определението на кръв CK-MB маса. При повечето пациенти, нивата на GF-BB значително увеличени след 4 часа след началото на ангина и инфаркт на миокарда при пациенти с неусложнена завръщане към нормална рамките на 48 часа.
Лактат - олигомерен протеин с молекулно тегло от 134 000 D, състояща се от четири субединици на два вида: M (от английски, мускулна - мускул) и Н (от английски език, сърце - сърцето). Комбинацията от тези субединици в основата на формирането на 5 изоформи на лактат дехидрогеназа (Фиг. 2-35, А). LDG1 LDG2 и са най-активни в сърдечния мускул и бъбреците, и LDG4 LDG5 - в скелетната мускулатура и черния дроб. В други тъкани, има различни форми на този ензим.
дехидрогеназа Ензимната лактат (LDH) катализира обратимата окислителната реакция лактат (млечна киселина), за да пируват (пирогроздена киселина).
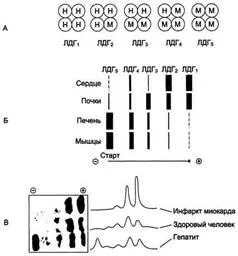
Важна стъпка напред е изучаването на LDH изоензими. Известен пет изоензими на ЛДХ. Те са номерирани според тяхната скорост на миграция по време на електрофореза. Първият се нарича най-бързо, а петият - най-бавния изоензим. За всеки орган характеристика на определено съотношение на LDH изоензими - т.нар изоензим профил или спектър LDH. Докато почти всеки орган съдържа всичките пет изоензими, техния профил е доста специфична и стабилна. Така например, в сърцето LDG1 се съдържа предимно в белите дробове - и LDG2 LDG3 в черния дроб на - и LDG4 LDG5.
В остър инфаркт на миокарда в серума предимно повишава активността на LDH, която е не само по-рано, специфичен, но и по-чувствителен тест на остра миокардна некроза, както често се определя в тези пациенти, при които общо LDH не надвишава горната граница на нормата.
Изследване изоензим профил на серум LDH, не само значително увеличава информация стойността на този тест в диференциалната диагноза между миокарден инфаркт и други форми на заболяване на коронарната артерия, но също така дава възможност да се уточни диагнозата на остър инфаркт на миокарда в фонови аритмии или перикардитът на, след кардиоверзия и ако има и други усложнения.
- LDH изоформи се различават в електрофоретичната подвижност, която позволява тъканта принадлежност изоформи на LDH.
- Появата в развитието на различните изоформи на LDH поради особеностите на метаболизма оксидативен тъкан. Изозими LDG4 и LDG5 (М-тип LDH) действа ефективно при анаеробни условия, LDH и LDG2 (H-тип) - аеробно когато пируват бързо се окислява до СО2 и Н2 О и не намалява до млечна киселина.
- Редица заболявания изследва активността на LDH в кръвната плазма. Обикновено, активността на LDH е 170-520 U / L. Повишена активност се наблюдава при остри увреждания на сърцето, черния дроб, бъбреците, както и мегалобластна анемия и хемолитична. Въпреки това показва увреждане на само един от тези тъкани.
Диференциална диагноза проучване изоформи на LDH в кръвната плазма чрез електрофореза. Фигурата представени в плазмата на здрави човешка кръв electrophoretogram пациентите, инфаркт на миокарда и пациенти с хепатит. Идентификация на плазмени кръвни tkanespetsifiches кал изоформи на LDH се използва като диагностичен тест на увреждане на тъкан. Много други заболявания, при които се увеличили общата активност на LDH също могат успешно да се различават от остър инфаркт на миокарда, защото характеризира с увеличаване на активност поради бавното izomeazitov. Ако по-нататък като фон развива инфаркт на миокарда, може да се определи да се увеличи LDG1 фракция дори ако цялостното си активност не се променя.
От особен интерес са резултатите от проучване на спектъра на CK изоензим. Увеличението на СРК активност в кръвта е доказателство за увреждане на миокарда.
Изследването на ензимната активност на метод кръв -perspektivny интравитална количествена оценка на миокардна некроза. За тази цел определянето на ензимната активност на СК. Общо ензим влезе в кръвния поток от зоната на некроза може да бъде определена в изследването на неговата активност в серия кръвни проби на базата на разработения модел, като се вземат предвид изходната скорост на ензима на миокардна некроза в общото кръвообращение, скоростта на изчезване на кръвта му, част от инфаркт ензим инактивира в местоположение и обем, в който се разпространява от освободения ензим миокардна некроза.
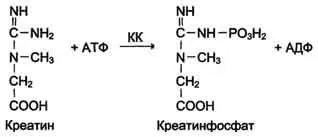
Креатин киназа (СК) катализира реакцията на образуване на креатин:
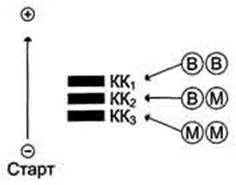
Молекула QC - димер, състоящ се от два вида субединици: M (от английски, мускулна - мускул) и В (от английски, мозъка - мозъка). От тези субединици формират изозимен 3 - BB, MB, ММ. BB изоензим се открива предимно в мозъка, мм - в скелетната мускулатура и MB - на сърдечния мускул. CK изоформи имат различна електрофоретичната подвижност (фиг.). креатин молекула се състои от две части, които могат да бъдат представени чрез една от двете субединици: M, от английски мускул - "мускул", и В, мозъка - "мозък". По този начин, креатин киназа в човешкото тяло е във формата на три изомери: MM, MB, BB. ММ-изомер, съдържаща се в скелетните мускули и миокарда, CF - предимно в миокарда, BB - в мозъчните тъкани в малко количество във всички клетки на организма.
При здрави човешка кръв креатин киназа присъства в малки количества, най-вече под формата на MM-изомер. креатин киназата, е зависимо от възраст, пол, раса, мускулната маса и физическа активност.
скорост QC активност не трябва да надвишава 90 IU / L. Определяне на QC в кръвната плазма е диагностична стойност за инфаркт на миокарда (CF настъпва повишаване изоформа). Номер MM изоформа може да се увеличи до наранявания и повреди на скелетните мускули. Изоформа BB не може да проникне през кръвно-мозъчната бариера, така че на практика няма кръв се определя и дори когато ходът има диагностична стойност.