Измерването на потенциала на електрода

Начало | За нас | обратна връзка
Понастоящем не съществува метод за измерване на абсолютната стойност на потенциала на индивидуалния електрод, но може да бъде определена чрез конвенционални количествена стойност на потенциала на електрод по отношение на всеки друг електрод, който е избран като референтен електрод.
Като референтен електрод е избран и сега се използва стандартен водороден електрод.
Такова електрод се състои от платина фолио потопен в разтвор, съдържащ водородни йони и който непрекъснато се промиват с водород газ. Газообразен водород има 1 атмосфера налягане и активността на водородните йони в разтвора е 1 ((uproschenno- когато концентрацията = 1).
Следващата реакция се провежда на електрод водород:
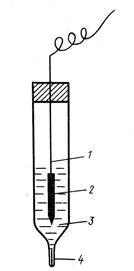
1, разтвор, съдържащ Н + йони (А + = 1)
2- електролитна ключ (сол мост)
3 потенциал електрод се измерва,
4- електролитна ключ (епруветка с разтвор на електролит)
Потенциалът на електрод е ЕДС на клетката, който се състои от определен електрод и стандартен водороден електрод
Ако го използвате правилно, рН електрода може да даде много точни резултати, възпроизводими да 0.00001V. Но неговата голяма чувствителност (зависимост) на външни условия силно затруднява неговото използване, следователно, друг електрод е по-стабилен с точно известен потенциал електрод се използва като референтна вместо електрод водород. Един от най-често - хлор-сребърен електрод, който е сребърен проводник, покрит с AgCl и се потапя в разтвор, калиев хлорид (обикновено - наситен).
1- сребро тел,
2 - сребърен хлорид,
4 - електролитни ключ (капилярен запълнена с инертен порест
вещество, импрегниран с разтвор на калиев хлорид)
Клетката се състои от 2 части, всяка от които съдържа един електрод. Промяна на едно от парчетата, можете да създадете много различни галванични клетки.
Електродвижещата сила на електрохимичната клетка (електродвижеща сила) е максималната стойност на потенциалната разлика между електродите:
Къде са JC - катод потенциал,
йа - потенциала на анода.
Окисляването върху анода става и възстановяване - на катода.
Пример запис електрохимична клетка, съдържаща електрод в разтвор на Zn и Си електрод ZnSO4 CuSO4 в разтвора:
(-) Zn çZn 2+ ççCu 2+ çCu (+)
(-) Zn çZnSO4 ççCuSO4 çCu (+)
Zn çZn2 + е потенциален скок на границата на йон разтвор метал-метал
ZnSO4 ççCuSO4 показва дифузно потенциал скок електрод между двата разтвора.
Дифузията потенциал е потенциална разлика, възникващи в интерфейса между 2 решения, различаващи се по форма или разтворено вещество дали на неговата концентрация.
Максималният полезен труд клетката. При извършване на обратима реакция на всяко преминаване при постоянна температура и налягане, получен от него ще работи максимална работа A'max реакция. Извършената от галваничен елемент в тези условия работата, е EDS елемент, умножена по количеството електроенергия, преминали. Ние ще изрази количеството на вещества, които са подложени на трансформации в резултат на реакции в единици на грам-атома на елемент (или грам-йонна комплексни йони). Количеството на електроенергия, която съответства на такова превръщане (С-С-атом или йон) е равна на СИ х F кулони
Къде са пе - йонна заряд,
F = 96 487 Кулон / мол (или Kd х мол -1) - константа (число) Фарадей
(Физически смисъл на Фарадей - заряд 1gramm атом (или йон) вещество).
където W'max - наименование работа в електрохимията.
б х B + D х D Û р х Q + R х R
E = - = = E о - LN
Е = Е о - LN - Нернст уравнение.
Е о - EMF на клетката при стандартни условия, когато CB = Cd = CQ = CR = 1
Е о стойност - наречено нормално (или стандарт) EMF елемент.
Ако вземем електрохимичната клетка със стандартен потенциал водороден електрод след металния електрод е равен на: J = й о + lncM
Когато са й о - стандартна електрод потенциал - т.е. потенциал, който се появява, когато активността (концентрация) на металните йони е равна на единица.
Изчислява потенциала електрод на различни метали в техните солеви разтвори с различни концентрации е възможно с помощта на уравнението Нернст и стойностите на стандартни електродни потенциали на металите, които могат да бъдат намерени в наръчници.
Стандартни електродни потенциали на различните електроди могат да бъдат подредени в така наречените стрес гама - електрохимична серия от метали активност (брой стандартни електродни потенциали) - последователност, в които металите са подредени във възходящ ред на стандартни техните електрохимични потенциали # 966; 0. съответната половина реакция на редуциране на метален катион Me п +:
Me п + + п # 275; → Me
Няколко стрес характеризира относителната активност на метали в редокс реакции във водни разтвори.
В Международния съюз по IUPAC (Union чиста и приложна химия) приема, че потенциалът на метали, които по отношение на стандартен водороден електрод е отрицателен са написани с "минус" преди тяхната стойност. Ако метал по отношение на стандартен водороден електрод - е положителен, неговата стойност се записва със знак плюс.
Поляризация - на деформация електродни потенциали от неговата равновесна стойност, когато електрически ток. Поляризация намалява EMF на клетката и нивото на електролиза.
Концентрация поляризация се дължи на промени в концентрацията на йон до повърхността на електрода от електрохимичната реакция:
Концентрацията на Zn2 + йони се увеличава
Концентрацията на Си2 + йони се намалява
Химическа поляризация се дължи на промяна на състоянието (характер) на повърхността на електрода под влиянието на електрохимически реакционни продукти (образуването на вещества на повърхността на електрода, които пречат на електрохимична реакция):
2Н + + 2е ® Н2 - (обхваща повърхността на електрод)
Реакцията може да бъде промяна метален електрод за "водород" (например, меден електрод може да бъде "реализация," в водород)
Dj = й о Н2 - к о Cu = - 0.337 V
И двата вида поляризация може да се намали чрез различни методи, които се наричат деполяризация.
поляризация на концентрация може да бъде значително намалена с интензивно разбъркване разтвор. Химическа поляризация може да бъде намалено чрез добавяне на вещества, които ще реагират с тези вещества, които са причинени поляризация. Например, като depolarizer за реакцията, в резултат на водород газ се освобождава, е възможно да се прилага водороден пероксид и намаляване деполяризация: