Измерване на ензимната активност
Концепцията на ензимите
Ензими (ензими), наречени разтворими или мембранно-свързани протеини притежават каталитична активност. (С изключение протеини каталитична активност в тялото може да показва някои РНК (рибозими) и антитела (абзими), но те са по-малко ефективни в хиляди пъти, от ензими.) Тези имена идва от латинската «fermentatio» - ферментация и гръцки «ен zym» - в рамките на квас. Те напомнят на първите източници ензими. Biochemistry която изучава ензими, наречени Enzymology. Диаграмите и уравненията на реакции на ензими в молекулата са - Е. Веществата, които катализират превръщането на ензими, наречени субстратите (S). Продукти от ензимната reaktsiioboznachayut - П. Тъй ензими са протеини, които се получават в хомогенна форма по същия начин като други протеини. За ензими характерни физико-химични свойства, присъщи на протеини.
За разлика от ензими от неорганични катализатори:
а) ускоряване на реакцията е много по-ефективно;
б) са надарени с висока специфичност на действие;
в) подлага на регулирането при физиологични условия;
ж) да работи при умерени условия.
Ензимите могат да бъдат както прости и сложни (конюгирани) протеини, които могат да включват липиди, въглехидрати, метални йони, азотни основи, производни на витамини. В тялото може да функционира като ензими в разтворимо състояние и под формата на неразтворими комплекси или да бъде част от биологичните мембрани.
Отличителният белег е наличието на активното място на ензима. Активното центъра - уникална комбинация от съседни аминокиселинни остатъци в пространството, който гласи:
а) молекула признаване субстрат,
б) субстрата свързване с ензима,
в) извършване на каталитични трансформации (в случай на комплекс акт ензим катализа като коензим участва, част от активния център).
Активен сайт се извършва в момент, когато протеинът се сгъва и да приеме своята нативна (активно) конформация. Структурата на активното място може да се променя чрез взаимодействие с основа. В фигуративен израз D. Koshland субстрат, подходящ за активния център на ръката на ръкавицата.
Един ензим молекула, особено ако тя се състои от няколко подединици могат да съдържат повече от един активен сайт.
В активния център има две секции. Първата част е отговорна за разпознаване и свързване на субстрата. Тя се нарича субстрат-свързващи сайта, или котва подложка. Втората част се нарича катализатор, той е съставен от аминокиселинни остатъци, участващи в катализа акт.
Ензимите са протеини, които се различават значително в молекулно тегло и структурна сложност. Един пример на малка молекула ензим с рибонуклеаза се състои от отделна субединица на молекулно тегло 13,700 Да. (U рибонуклеаза определена аминокиселинна последователност. През 1969, рибонуклеаза се синтезира в лабораторията B.Merrifilda в Ню Йорк). Много ензими са съставени от няколко субединици, като лактат дехидрогеназа се състои от четири субединици на два вида. До момента известни някои мултиен комплекси, състоящи се от десетки различни видове субединици и няколко коензими. Например, пируват дехидрогеназа комплекс се състои от 60 субединици на трите вида и пет вида кофактори. Молекулното тегло на този комплекс е 2.3 * 10 6-10 * 10 юни да зависимост от източника на ензима. Молекулата на ензим може да бъде по-малък от молекулата на субстрат. Например: молекули амилаза и рибонуклеаза ензими по-малко от тяхната молекула субстрат - нишесте и РНК.
белтъчен комплекс на ензима е каталитично неактивен и се нарича ароензим. Свързването апоензим с небелтъчни компонент води до образуването на каталитично активен ензим (холоензим):
Много ензими съдържат в структурата на металния йон, който може да изпълнява различни функции:
а) участват в свързването на субстрата и каталитичен процес на преобразуване;
б) насърчаване на спазването на коензим на молекулата на ензим;
в) стабилизиране на третичната структура на ензима (например Са2 + в амилаза);
г) свързване на субстрата за образуване на истински субстрат, в който ензимът действа.
Много коензими са производни на витамини, следователно, метаболитно нарушение недостиг на витамин поради намалена активност на някои ензими.
Някои ензими в допълнение към активния център съдържа алостеричен (регулиране) Център - обект на протеин глобули на извън активното място, които могат да се свързват с вещества, които регулират ензимната активност. Тези вещества се наричат алостерични изпълнителни (алостерични активатори или инхибитори). В резултат на свързване с алостеричен ефектор център променя структурата на протеина, което води до промяна в пространственото подреждане на аминокиселинните остатъци в активния център и в крайна сметка да променят активността на ензим.
намерени ензими в един организъм и катализират същата химическа реакция, но с различна първична структура на протеина, наречени изоензими. Изозими различават един от друг от тези физико-химични свойства като молекулно тегло, термична стабилност, субстратната специфичност, електрофоретичната подвижност. Nature вид на изоензими варира, но най-често се дължи на различията в структурата на гените, кодиращи тези изоензими или субединица. Например, ензим лактат дехидрогеназа (LDH), катализира обратимата реакция на окисление на лактат да пируват има четири субединици на два вида М и N, комбинацията от субединиците е в основата на формирането на пет LDH изоензими (фиг.1). За диагностика на сърцето и заболявания на черния дроб трябва да учат изозим спектър от серум LDH като LDG1 и LDG2 активен в сърдечния мускул и бъбреците, и LDG4 и LDG5 - и скелетната мускулатура и черния дроб.
Фиг.1 Структура на различните изоензими на ЛДХ.
Измерване на ензимната активност
Определяне на ензимната активност се извършва чрез измерване на скоростта на реакциите катализирана. Скоростта на ензимната реакция се измерва чрез намаляването или увеличаването на субстрат концентрация концентрация продукт за единица време:
където # 916; Cs - промяна на моларната концентрация на субстрата (мол / л)
# 916; CP - промяна на моларната концентрация на реакционния продукт (мол / л)
# 916; # 964; - се променя с времето (минути, секунди).
Кинетичните изследвания желателно провеждат при насищаща концентрация на субстрата, в противен случай ензима не ще бъде в състояние да демонстрират максимална активност.
Единици за ензимна активност:
Международната единица ензим (U) - е количество ензим, който катализира превръщането на 1 микромол субстрат в 1 минута, при 25 ° С и оптимално рН.
Единицата за ензим SI е катал (кът) е това количество ензим, което катализира превръщането на един molsubstrata за 1 секунда. Лесно е да се изчисли, че:
1 U = (1 х 10 6 М) / 60 = 1,67 * 10 -8 М-1 = 1, 67 х 10 -8 Cat = 16.7 nkat.
Често определяне на специфичната активност на препаратите на ензимната активност чрез разделяне подготовката на пробите ензим, изразени като (U), по отношение на теглото на пробата в милиграми:
Од = U / маса на лекарството (мг)
При почистване ензими специфични активност се увеличава. Чрез увеличаване на специфичната активност може да се съди за ефикасността на пречистване и чистотата на етапите на ензимен препарат.
За оценка на активността на силно пречистени хомогенни препарати от ензими раздели броя на международни единици (U) на ензима в пробата с количеството вещество ензим (пикомола) в пробата се изчислява моларен активност (брой на оборотите). Физически, моларното активност - е броят на субстратните молекули, които се превръщат в една молекула ензим на 1 минута или 1 секунда. Например: за уреаза ускоряване хидролиза на карбамид, моларното активност е 30 000, трипсин - 102, глюкоза оксидаза - 17,000 цикъла в секунда.
4.1. Механизмът на действие. Ензими не изместват реакцията равновесие катализирана към образуването на продукти, като по този начин равновесието на реакцията постоянно остава постоянна. Както всички катализатори, ензими се намаляват само времето, за да се постигне този баланс. В повечето случаи ензимите се ускори реакцията при 10 на 7-10 14 пъти. В основата на ефективността на ензимната катализа е силно намаляване на енергията на активиране на реакцията чрез превръщане на субстрат на продукт чрез преходни състояния.
4.2. Спецификата на действие. Специфичността на свързване към субстрата и пътя на потока определя чрез ензимна реакция на апоензим. Специфична характеристика на ензимна активност, насочена определя метаболизма на организма.
За Ензимите се каже, че имат тесен субстратна специфичност. ако те работят в много малък кръг от субстрати. Понякога е възможно да се говори за абсолютната субстрат специфичност, например, каталаза катализира само една реакция - разлагане на водороден прекис:
За повечето ензими се характеризират с относителна (широк, група) субстрат специфичност. когато те катализират група подобни реакции. Така например, алкохол дехидрогеназа катализира превръщането на алкохоли до алдехиди, при което като субстрати могат да действат като метанол, етанол, пропанол и други алкохоли. От интерес е фактът, че дехидрогеназа алкохол може да се окисли и нелинейни алкохоли и алкохолна група, която е част от сложни молекули, по-специално този ензим може да катализира превръщането на ретинол в ретината. Естествено, ензими, притежаващи широка субстратна специфичност, катализират превръщането на субстрати с различна ефективност.
Ензимите са надарени с стереохимична специфичност. тяхното активно място на молекулата признава субстрати на пространствена конфигурация. Например, L-аминокиселинна оксидаза активен срещу само L-амино киселини и абсолютно никакъв ефект върху техните D-аналози. За оксидативното деаминиране на D-амино киселини в живи организми са D-аминокиселинна оксидаза, не действа на L-амино киселини. Той е активен център на способността да се свързват с някои стереоизомери на субстрата в основата на действието на ензими, такива като рацемаза които един стереоизомер се превръща в друга.
пътеки Специфична реализация е, че един субстрат под действието на различни ензими, могат да бъдат превърнати до продукти, които се различават по структура и роля в обмяната на веществата.
Ето един пример: L-аминокиселинна оксидаза акт на L-амино киселини, да ги трансформира в алфа-кето киселина с образуването на амоняк и водороден пероксид.
L-аминокиселинна декарбоксилаза свързват същите субстрати но катализира различен реакция: декарбоксилиране с образуване на биогенни амини и отделяне на въглероден диоксид.
Друг пример е възможността за превръщане на глюкоза-6-фосфат чрез действието на различни ензими, един от възможните пътища:
Подобно на много протеини, ензими при по-високи температури претърпяват термична денатурация, което нарушава нативната конформация на ензима и промяната в активна структура сайт. ензими бозайници започват да денатурира значително при температури над 40 ° С
Във връзка с посочените по-горе ензимни препарати е желателно да се съхранява при ниски температури. Един от най-добрият начин да се запазят техните ензими е лиофилизация (изсушаване при температура под -70 ° С под вакуум) се превежда в частично денатуриран състояние използване амониеви соли и поставяне в хладилник.
4.4. Зависимостта от скоростта на реакцията на температура. Скоростта на ензимни реакции, като всички химични реакции зависи от температурата. Тъй като температурата се повишава от 10 ° С скоростта на реакцията се повишава от 2-4 пъти по правило Van't Hoff. Въпреки това, при температури над 40 ° С става значително денатуриране на ензимите, което намалява общата активност (Фигура 2) .:
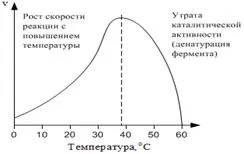
Фиг. 2. зависимост от температурата на скоростта на ензимната реакция.
4.5. Зависимостта от скоростта на реакцията на рН. Зависимостта от скоростта на ензимната реакция рН има форма на камбана форма (фиг. 3). РН, при която най-високата наблюдавана скорост на ензимни реакции се нарича оптимум (рН оптимално). Естеството на кривите и рН-оптимума зависи от вида на основата и на заредените групи на заредените групи на ензима (особено тези в активния сайт). оптимално рН за повечето ензими е в границите от 6.0 до 8.0 (Фиг. 3).
Фиг. 3. Зависимост на ензимната скорост на реакцията на рН.
Въпреки това, има и изключения, например, пепсин е най-активен при рН 1.5 - 2.0, и алкална фосфатаза при рН 10.0 - 10.5 (Фигура 4).
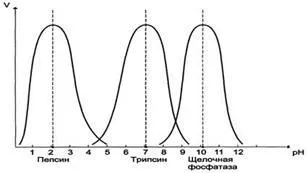
Фиг. 4. Зависимостта на ензимната реакционна скорост (V), рН на средата.
В екстремни (ниско или високо) нарушение възниква рН третична структура на молекулата на ензим, което води до загуба на ензимна активност.