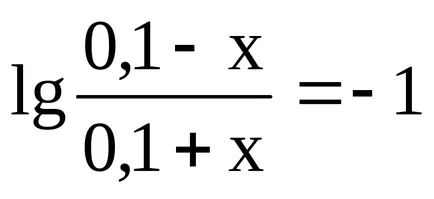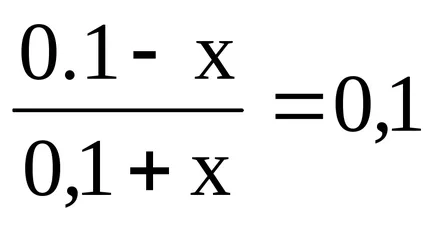Изчисляване на рН буфери 1
Изчислете рН буферен разтвор, съдържащ в 1 л 0,1 М оцетна киселина и 0,1 мола натриев ацетат.
Концентрацията на водородни йони се изчислява от дисоциационната константа на оцетна киселина:
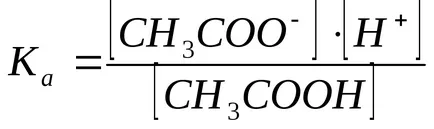
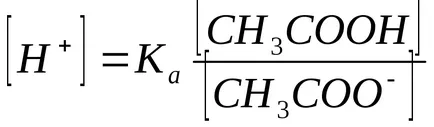
В присъствието на натриев ацетат равновесие дисоциация ацетат измести наляво, така че може да се предположи, че
Като цяло, за буферен разтвор образувани чрез смесване на слаба киселина и сол:
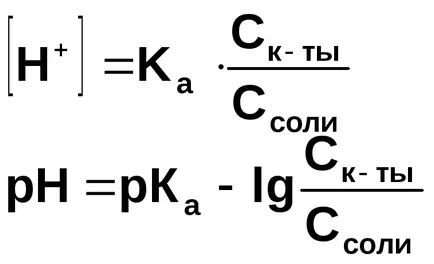
Изчислете рН буферен разтвор, съдържащ в 1 литър от 0.01 мола на амониев хидроксид и 0,1 мола на амониев хлорид.
Концентрацията на хидроксиден йон изчислява от дисоциационната константа на амониев хидроксид:
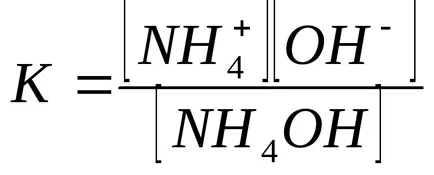
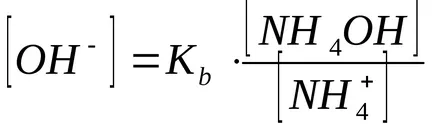
В присъствието на амониев хлорид, амониев хидроксид равновесието на дисоциация се измества наляво, така че може да се предположи, че
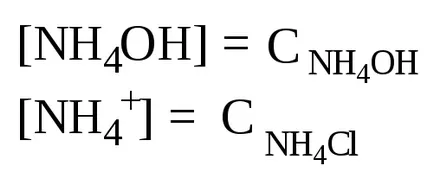
Изхождайки от йон продукта от вода, се изчислява [Н +] и рН на разтвора:
Като цяло, за буфериращи разтвори образувани чрез смесване на слаба основа и нейната сол:
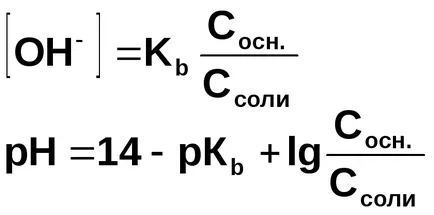
Механизмът на действие на системите за буферни
Действието на буфериране се основава на компонентите на свързващ буфер система влизат в разтвора на йони Н + и OH - йони за образуване слаби електролити.
Ние се изчисли как да се промени рН на буферния разтвор от 1 литър с концентрацията на оцетна киселина и натриев ацетат в 0,1 мол / л, добавяйки към него: а) 0,01 molHCl; б) 0.01 molNaOH; в) при разреждане 10 пъти.
а) При добавяне към буферен разтвор HCl излишък Н + йони се свързват ацетат анион в молекулата на слаб електролит оцетна киселина:
Концентрацията на молекулно оцетна киселина, за да се увеличи с 0.01 мола / литър, и концентрацията на ацетатни йони ще намалее със същия размер:
[CH3 СООН] = 0,1 + 0,01 = 0,11 мол / л
[CH3 COO -] = 0,1 - 0,01 = 0,09 мол / л
рН-LG 2,1410 -5 = 4,67
Така рН на буферния разтвор намалява от 4.76 до 4.67, т.е. 0.09. (За сравнение, добавяне на 0.01 мола солна киселина до 1 литър вода с рН в границите 7-2, т.е. 5 единици).
б) При добавяне на NaOH към разтвор на буфер, излишните йони ОН - ще взаимодействат с молекулите на оцетна киселина за да се образува слаб електролит вода:
Концентрацията на молекулно оцетна киселина се редуцира до 0.01 мол / л и концентрацията на ацетатни йони ще се увеличи от същото количество:
[CH3 СООН] = 0,1 - 0,01 = 0,09 мол / л
[CH3 COO -] = 0,1 + 0,01 = 0,11 мол / л
рН-LG 1,4310 -5 = 4,84
По този начин, при добавяне на алкални промени рН само леко (с 0.08).
в) При буфер за разреждане в 10-кратна концентрация на неговите компоненти също са намалени с 10 пъти, и ако не се вземат предвид промените в степента на дисоциация на оцетна киселина при рН разтвор разреждане не се променя:
рН-LG 1,7510 -5 = 4,76.
Способността да буферни системи за поддържане на постоянството на рН на буфера се определя и ограничен капацитет на разтвора.
Капацитетът на буфер е равен на броя на еквивалентите на киселина или основа, чрез добавяне на рН на разтвора се променя от един.
Капацитетът на буфер зависи от концентрацията на буферни компоненти и техните връзки. Той се увеличава с увеличаване на концентрацията на разтвора и достига максимална стойност при концентрация равна на неговите компоненти.
Всеки буфер система има работен обхват на рН, след което буферен капацитет пада рязко. Към разтвор на буфер, съставен от слаба киселина и сол, обхвата работа рН е в рамките на рКа 1.
Пример. Изчислява буферния съд по отношение на разтвор, съдържащ киселина в 1 литър от 0.1 М амониев хидроксид и 0,1 мола на амониев хлорид.
рН на разтвора на храна се изчислява като:
Нека буфер капацитет на разтвор киселината от х. Така х - е броя молове на киселина се прибавя към разтвора до рН намалява до една, т.е. Това е равно на 8,26.
При добавяне към х мола солна киселина се среща реакционен разтвор:
Така концентрация NH4 OH се намалява до (0.1 - х), и NH4 + увеличава концентрация (0.1 + х). Замествайки тези изрази във формулата за изчисляване на рН на разтвора, получаваме: