хомогенна система
Хомогенна система (от хомо. U. Gene) термодинамична система, всички от които характеристики (например химически състав, плътност, налягане) са постоянни или променя непрекъснато в пространството. Хомогенна смес от газове, може да бъде течни или твърди разтвори и други системи. Разлика е пространствено хомогенна и хетерогенна, хомогенна система. В хомогенна система хомогенни свойства в различни части на системата са еднакви, в хетерогенна - различно. Примери за пространствено нехомогенни хомогенни системи: газове, течности, газови смеси, разтвори във външна област при условие, че в отсъствието на областта са пространствено хомогенна. Въпреки това, поради непрекъснатата промяна в свойствата на нехомогенни хомогенна система, за разлика от хетерогенна система, няма части на раздели повърхности, на която най-малко собствеността се променя рязко. Хомогенна една фаза система, но тя може да бъде многокомпонентна.
Хомогенна катализа, увеличаване на скоростта на химични реакции в газа или течна фаза, чрез действието на катализаторите са в една и съща фаза като реагентите. хетерофазов реакция CO В + Н2 О → ← СО2 + H2 може да бъде хомогенна каталитична реакция, тъй като обемът на катализатора се провежда в разтвор (например, Rhl3) с разтворен CO.
Характеристики на хомогенно катализирани процеси. Основните характеристики на процеса са хомогенни каталитични количества катализатор активност и селективност на катализирана реакция. Селективността може да бъде представена чрез съотношението на реакция изходна суровина се превръща в желания продукт, като се вземат предвид стехиометрията на реакцията. За експресия на каталитичната активност се използва или фиксирано съотношение на първоначалната скорост на реакция на моларната концентрация на активната форма на катализатора - така наречената скорост (или честотата) на катализатора на оборотите (посочено TOF, от английски завой по честота). На практика често използват свързани с TOF, но не е идентичен с него количество - съотношение на общото моларно количество на реакционния продукт на общото моларно количество на катализатора и времето на реакция, която също се нарича TOF. Визуална характеристика активност и стабилност на катализатора е броят на оборотите на катализатора (TON, завой по брой), равен на броя на каталитични цикли по отношение на 1 мол катализатор (изразено като съотношение на моларното количество на реакционен продукт на моларното количество на катализатора).
Класификацията на хомогенни каталитични процеси и механизми. .. Въз основа на естеството на катализатора, т.е. специфичен капацитет за взаимодействие със субстрата, хомогенни каталитични процеси са разделени на следните видове: киселинно-основна катализа протонни киселини или основи Йоханес Брьонстед електрофилно (включващи апротонни Люисови киселини) и нуклеофилно (с бази Lewis) катализа, метални комплекс катализа метални съединения, катализа на синтетични органични съединения и ензимна катализа.
Кисел катализатор - активиране субстрати с свободни електронни двойки, протонни киселини (виж киселини и основи) - появява в резултат на добавянето на протонна киселина към субстрата. Протонизиране на субстрата в разтвори водна киселина е обикновено реакционната вода заместване в хидратирана катион Н (Н 2О) + п молекула субстрата. Междинните активните видове в кисела катализа често служат карбениевият йон R +. която е същата като на протонната солватирани молекулите на Н2 О, органични разтворители или силни киселини, например R (Н 2О) +. (С2 Н5) 3 О +. RH2 SO + 4. основна катализа - активиране Йоханес Брьонстед базите - е резултат на разцепване на протон от базова субстрат за формиране на субстрат молекулата на анионните частици е много силен нуклеофил. Така хидратиране на алкени в присъствието на силни минерални киселини - киселинно катализирана реакция типично - може да бъде представен като последователност от етапи:
алдолна кондензация на ацетон в присъствието на алкален - основна катализа например - под формата:
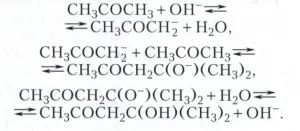
Много силна протична киселина (Superacids), способен направи официални услуги съединение като няма свободни електронни двойки, като алкани, за образуване на карбониев йон RH + 2 (СНЗ + 5 и т.н.). Въглеродни йони, които участват в реакциите на алкилиране, напукване и изомеризация на алкани.
В електрофилно катализа - активиране електрофилно апротонен Люисова киселина - се придружава от намаляване на плътността на електрон реакция субстрат центъра (Люис база) до образуването на карбениевият йон на. Чрез този механизъм се случва по-специално алкилирането на ароматни съединения; например алкилиране на бензен с алкил бромид схема С6 H6 + RBr → С6 Н5 R + НВг включва образуване на реактивен комплекс R + [Al2 Br7] - в резултат на взаимодействие с катализатор Al2 Br6 алкил бромид и действие карбениевият катион R + на молекулата на бензен с.
В реакциите на халоген-съдържащи молекули (.. СВг4 формула RCOCI, SO2 Cl2, и т.н.) или с Al2 VR6 Al2 SL6 възникне superelektrofilnye частици (например, CBr 3 Al2 + Br - 7). Superelectrophiles катализират крекинг на алкани при меки условия.
Протич и апротонни (електрофилни) катализатори за ускоряване на процеса на алкилиране, ацилиране, синтез диен и дори някои реакция редокси. Например, протонни киселини катализират окислението на изопропанол с ацетон trifenilkarbinolom чрез стъпка трифенилметил образуване катион (С6 Н5) 3 C +. апротонни киселини (алуминиеви алкоксиди) - намаляване на кетони с алкохоли (диазометан - Ponndorfa - Verley реакция) и диспропорциониране на алдехиди (Тишенко реакция) чрез образуване на комплекс между алкоксида Al и карбонил съединение.
Нуклеофилно катализа на бази Lewis се случва да се образува междинен адукт-нуклеофилна катализатор към субстрат (например електрофилна бромиране на алкени в присъствието на халогенидни йони), или да образуват междинни продукти заместване (например, заместване на наситен въглероден атом е хидролизата на алкилхалогениди в присъствие на аниона I - - активна нуклеофилна катализатор и след това лесно се група).
Когато катализ органични съединения функционални катализатори обикновено са по-сложни от електрофили или нуклеофили. Примери за този вид хомогенна катализа - автокатализ гликол алдехид формалдехид кондензационен до захари в основна среда (Butlerova реакция), разлагането на пероксидни радикали катализирани п-бензохинон, съгласно схема
катализа аминокиселина (пролин) алдолна кондензация, Mannich реакция и други процеси.
В повечето процеси на катализа с метални комплекси се осъществява чрез междинни метални междинни съединения, включително тези, в типичен редокс процеси, включващи неорганични реагенти. Например, комплекси в катализата на Мо (III) намаляване на молекулярен азот с натриев амалгама схема N2 + 4Na + 4H2 О → NH2 NH2 + 4NaOH N2 в резултат от взаимодействие с Мо (III) комплекс [Mo 4+ -N = N-Mo 4+ ] Na действие, когато превръща анион [Mo 4+ = N-N = Mo 4+] 2-; взаимодействие на това междинно съединение частиците с Н 2О и води до образуването на хидразин (реакция отвори А. Е. Shilovym сътрудници). Само малък брой реакции електронен трансфер катализирани от метални комплекси, характерни междинни продукти, получени без да се образуват външната сфера електронен трансфер.
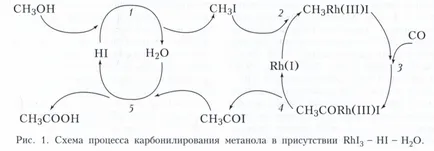
Най-често срещаният тип на метален комплекс хомогенна катализа - катализ реакциите на органични съединения с образуването на органометални междинни съединения с метал-въглеродни връзки, така наречените органометален катализатор. Типични органометален стъпка катализа се илюстрира от двата процеса. Произход - промишленото производство на оцетна киселина чрез карбонилиране на метанол в катализаторната система RhI3 - HI - Н2О Солта Rh (III) е прекурсор на активния катализатор - Rh комплекс (I), образувани чрез взаимодействие RhI3 + 3SO + Н 2О - Rh (CO) 2 I - 2 + СО 2 + HI + Н +. Механизмът на този процес може да бъде представена чрез циклична последователност от етапи (фиг. 1). Стъпка 1 - халоген заместване на хидроксилната група, етап 2 - СН3 I оксидативен допълнение към Rh (I), Етап 3 - въвеждане на СО СН3 комуникация -Rh, етап 4 - редукционно елиминиране atsiliodida СН3 ИСП, етап 5 - нуклеофилно заместване I - а atsiliodide вода. В този процес, с изключение на комплекс Rh (I), киселинен катализатор протонен участва в HI две каталитични цикли. Такива системи са посочени като многофункционални каталитични системи.
Втори пример - хидратация алкини, включващи три катализатори: комплекси на Cu (I) (комплекс катализа), тиол RSH (нуклеофилно катализа) и HCI (протонна киселина катализа) тече срещу правило Markovnikov (фигура 2). Стъпка 1 - образуване на π-комплекс, етап 2 - нуклеофилно присъединяване RSH на П-комплекс, Етап 3 - електрофилно заместване на Cu (I) протон, етап 4 - електрофилно добавяне на Н + (протониране tiopropenilovogo етер), етап 5 - нуклеофилно заместване тиол вода ,
катализа на метален комплекс изолира асиметрична катализа използване на хирални метални комплексни катализатори, които позволяват да се извърши стереоселективни реакции (виж статия в асиметричен синтез). Например, в производството на Rh комплекси (I) с хирални фосфинови лиганди получава дихидроксифенилаланин (лекарство за лечение на болестта на Паркинсон).

Важно технически проблем с метална катализа - отделяне на катализатора от продуктите и катализатор рециклиране - се постига за сметка на имобилизация на метални комплекси, като се използват лиганди на повърхността на носител или в една от фазите използване двуфазни системи (например, органична фаза и вода, в която се разтваря метален комплекс); използване на органични стопени соли (йонни течности), в която метален комплекс се имобилизира прилагане ултрафилтрация мембрани за разделяне продукти и ispol'uet mations termomorfnyh лиганди или разтворител, промяна на температурата в зависимост от състоянието на фаза.
Практическо приложение. Сред най-важно промишлено хомогенно катализира процеса (с изключение на посочената по-горе) включват синтез с СО, олигомеризацията на етилен с напречно метатеза на терминал и на вътрешните алкени, димеризация на етилен и пропилей, хидрогениране функционално заместени алкени, нитро-съединения, епоксидиране на пропилей, окисление на алкилароматни съединения и т.н. . Много метални каталитични процеси за катализатор активност, химио-, регио- и стереоселективност на ензимната подход. Използване на структурни и функционални модели на ензими, биохимични принципи на процеси могат да се създаде ефективен метални комплексни катализ процеси (виж биомиметични реакция).