Хомогенна и хетерогенна катализа
Хомогенните каталитични реакции са широко разпространени в природата. Пример за промишлени хомогенни каталитични процеси може да служи реакция на естерификация, осапунване на естери и така нататък. D.
каталитичен механизъм на действие за хомогенна катализа е образуването на реактивни съединения между катализатора и междинните съединения, които в някои случаи дори е възможно да се разпредели. Ускоряване на реакцията в повечето случаи се извършва чрез намаляване на енергията на активиране. Когато хомогенна катализа в разтвор може да има каталитичен ефект на водородни йони, хидроксил, соли, както и вещества за насърчаване на образуването на свободни радикали.
Катализ чрез действието на водородни йони или хидроксилна наречен киселина - основни. Този тип катализа е най-често. Същността се състои в преминаване на протон от катализатора на реагентите (кисела катализа) или на реагент на катализатор (основна катализа). Впоследствие протон се движи в обратна посока и катализаторът се регенерира.

Скоростта на хомогенни каталитични реакции, се влияе от много фактори: активността на катализатор, температура, концентрация на катализатор, като се разбърква. Скорост много каталитични реакции зависи от концентрацията на катализатор. При малки стойности на х Scat добив продукт за даден период от време приблизително пропорционално на концентрацията на катализатора, но с по-нататъшно увеличение крива Scat става демпферирана
Течна фаза каталитична реакция обикновено се извършва в реактори с смесителни устройства.
хетерогенен катализ
Основният недостатък на хомогенна катализа катализаторът е трудността на изолиране на крайната реакционна смес, при което катализаторът се губи безвъзвратно продукт замърсен с тях. Ето защо, много по-популярни е хетерогенна катализа.
Въз основа на фаза са известни различни видове хетерогенен катализ: течни катализатори, които ускоряват реакцията между несмесващи се течности (или течности и газове) и твърдите катализатори, които ускоряват реакцията между течности или газове. Повечето каталитични реакции - един реакции газове, включващи твърди катализатори. Катализ на съществуващите теории, общи за всички теории е образуването на повърхността на катализатор междинен тип адсорбция катализатор твърдо вещество, включващо електрони.
Катализаторите обикновено са порьозни твърди вещества, които имат силно развита вътрешна повърхност. Всички каталитичен процес върху твърда пореста катализатор може да бъде представен под формата на пет отделни етапа:
Дифузията на реагентите от потока на повърхността на зърната на катализатора и в порите, съществуващи в зърното.
Активният адсорбция (хемисорбция) върху повърхността на катализатор, за да се образува междинно съединение съединения реагент - катализатор.
Пренареждане на атоми за да се образува междинен продукт - катализатор.
Десорбция на продукта от повърхността на катализатор.
Diffusion на продукта от повърхността на катализатор в порите, първите и по-късно от повърхността на зърното в общия поток.
Общият процент на общата каталитичен процес е ограничен от най-бавно от стъпките. Ако тази стъпка е една от стъпките на дифузия, катализата се извършва в района на дифузия. И прави разлика външна и вътрешна област дифузия. Ако бавен е 2, 3 или 4 етап, процесът отива на кинетичната региона.
Общото уравнение на скоростта на каталитичен процес в каталитично регион,
,
където
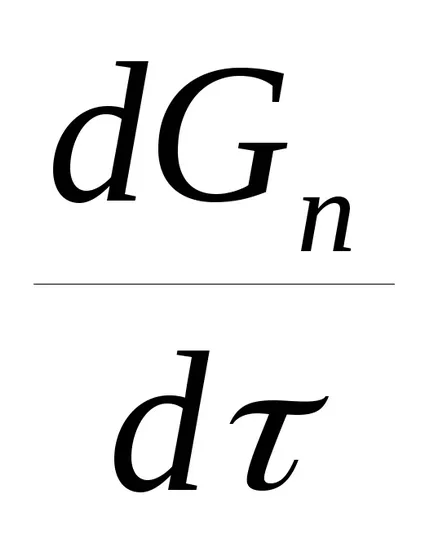
k0 - предварително експоненциален фактор в уравнението на Арениус;
V - насипен обем на катализатора;
д - основната натуралния логаритъм;
ΔS - движещата сила на процеса при атмосферно налягане;
Р1 - безразмерна налягане, т.е. действителното съотношение на налягането до атмосферното; ..
п - от порядъка на реакцията.
В областта на кинетични процеси се срещат в неактивни катализатори с малък размер на зърно и големи пори в режим на турбулентен поток на реактиви и ниски температури.
Ако процесът върви по външното поле. скоростта определя от коефициента на дифузия на реагентите и реакционните продукти. Съгласно закона, Фик
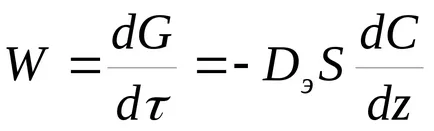
където De - ефективен коефициент на дифузия;
S - свободната повърхност на зърната на катализатора;
Z - посока, перпендикулярна на повърхността.
В областта на външните процеси дифузия се проведе в активността на катализатора. За да се ускори на големия дебит употреба процес.
В intradiffusion обща скорост на площ от каталитичен процес е ограничена от скоростта на дифузия на реагентите и реакционните продукти в порите на зърната на катализатора. Каталитични процеси в областта intradiffusion могат да ускорят намаляване на катализаторни зърна и увеличава радиуса на порите, но броят им се намалява и съответно повърхността.
Най-важните характеристики на катализатора са:
1. Температура на запалване - минимална температура на реакционната смес, при което процесът започва да се проведе с достатъчна скорост за практически цели. Колкото по-активен катализатор, по-ниската температура на запалване. Това е много важно при извършване на екзотермични обратими реакции от типа А = R + Q. тъй като е възможно да се увеличи степента на превръщане.
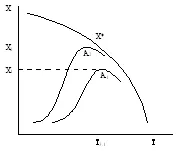
Степен на превръщане X екзотермична обратима реакция срещу температура за катализатори А2> А1 различна активност
По този начин е възможно да се намали предварително загряване на реагентите.
Времето за контакт - времето за контакт на реагентите с катализатора. определя
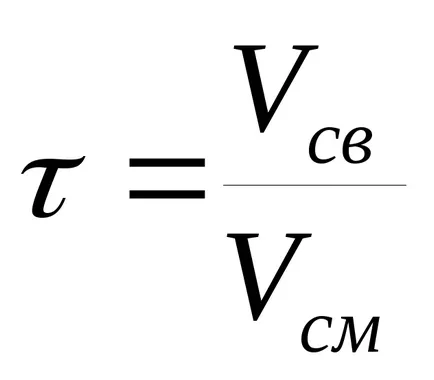
където VSV - без катализатор обем м 3;
Vb - обем на реакционната смес, преминаваща през катализатор м 3 / сек.
Най-често се използват фиктивни пъти за контакт
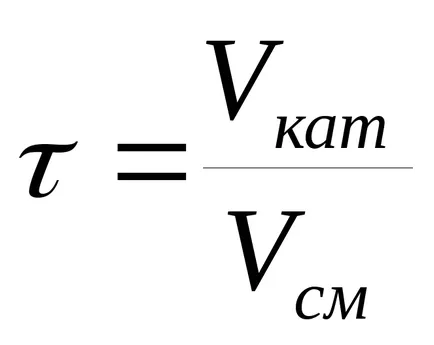
където Vkat - катализатор обем m 3.
Реципрочната стойност на времето за контакт, наречена обемна скорост - обем на реакционната смес, преминаваща през единица време.

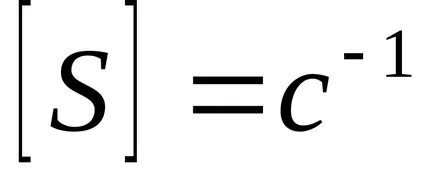
Чрез увеличаване на скоростта пространство, превръщането обикновено намалява, а след това се увеличава интензивността на устройството, т.е.. Е. увеличава количеството на желания продукт, произведен за единица обем на катализатора за единица време. Това се дължи на факта, че увеличаването на скоростта на потока на реакционната смес е далеч от равновесие и движещата сила ΔS голям.
Като пример, данни за влиянието на скоростта на място на скоростта на каталитичен процес амоняк синтез
Интензитетът на катализатора се изразява като уравнението
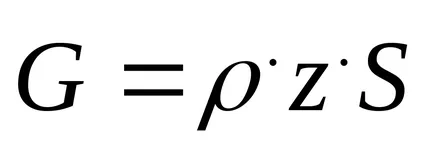
където G - производителността на катализатор, кг т-3 Н-1;
Z - мол от желания продукт в газовата смес;
S - обемна скорост, Н-1;
ρ - плътност на реагента, при нормални условия, кг / м3.
катализатор отравяне - частична загуба на активност в резултат на малко количество вещества, известни като контактни отрови. Тя се причинява от химическо взаимодействие с отровата катализатор с образуване на каталитично неактивни съединения.
Отравяне може да е обратима и необратима. Когато обратим отравяне на активността на катализатора намалява само при наличието на отровата във входящия смес. На допускане чиста смес с катализатора отровни съединения се разлагат, адсорбиран отрова летливо и дестилира заедно с продуктите на реакцията.
Необратимо отравяне е постоянен. Отровен катализатора трябва да бъде заменен с нов или стар регенерира. Най-чувствителни към отрови метални катализатори, особено благородни метали. За платиновия катализатор се използва в процеса на окисление са отрови Н2 S, арсенови съединения, метални йони Pb 2. Си ++. Sn +. Fe +. Чрез отрова хидрогениране катализатори включват Н2 S, PH3. NH3. O2.
Активността на катализатора може да се понижи по време на синтероване (повърхностни намалява), отлагането на примеси на повърхността си, като кокс.