хлориране на метан
Наситени въглеводороди активно реагират с хлор. Хлорирани алкани хлорни атоми или катиони, които са по-реактивен отколкото молекулно хлор. Дисоциация на хлорните атоми в молекулата изисква разход на 242.8 кДж / мол енергия. Такава дисоциация на хлор се извършва лесно при стайна температура под UV светлина абсорбцията на молекулата, която му дава 293.0 кДж / мол енергия. За термичната дисоциация на хлорни атома в молекулата, температура от около 300 $ ^ \ Circ \ C $. Хлорът молекула дисоциация в йони изисква разход на 1130,2 кДж / мол. От данните за енергийните то показва, че наситените въглеводороди, по-лесно да Хлорирайте света.
алкани хлориране случва с освобождаването на 108.8 кДж / мол от топлина е по-малко от екзотермична флуориране. Фотохимически хлориране на алкани се извършва при стайна светлина, тъй като директна светлина реакцията протича с експлозията. Когато хлорирането водородите алкани постепенно се заменя с хлор. В резултат, образуван hloropohidni наситени въглеводороди.
Така че, ако смес от метан и хлор за загряване до 200 $ ^ \ Circ \ C $, или работят върху него с UV светлина с подходяща дължина на вълната, преминаващ силно екзотермична реакция:
Фигура 1. хлориране на метан
Решете контрол по всички предмети. 10 години опит! Цена от 100 рубли. период от 1 ден!
Пишем евтини и точно навреме! Повече от 50 000 доказани професионалисти
Специална оферта! Даването на 100 рубли.
първи ред!
от 200 рубли / 2 часа от
от 350 рубли / 2 часа от
от 50 рубли / 2 часа от
Топлинният ефект на първия етап хлориране на метан в газова фаза до $ CH_3Cl $ и $ солна киселина $ може да бъде изчислена въз основа на Hess право.
Фигура 2. хлориране на метан
Общият термичен ефект на $ \ Delta \ подчертаване ^ \ Circ = - $ 25 ккал / мол. Тези данни показват, че хлориране на метан е много вероятно процес, въпреки че ефекта на топлина е по никакъв начин, свързани със скоростта на реакцията, което се определя от свободната енергия на активиране.Радикална механизъм хлориране на метан
Хлориране на алкани чрез нагряване, облъчване и в присъствието на радикални инициатори настъпва радикал верига механизъм $ SR $ (Semenov) и се състои от три основни етапа:
верига центрове (иницииране)
Фигура 3. хлориране на метан
Фигура 4. хлориране на метан
отворена верига (рекомбинация)
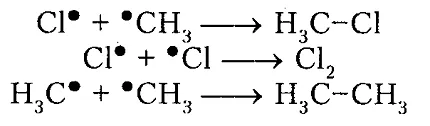
Фигура 5. Хлориране на метан
По този начин, хлорен молекула $ Cl_2 $ под действието на светлина ($ з \ пи $) или при нагряване получава излишък енергия става възбуден и се разделя на два атома, която по своята същност са радикал. хлорен атом, радикал в процеса на взаимодействие или сблъсък с други молекули разцепва водороден атом от молекула $ CH_4 $ метан да образува метилов радикал $ ^ * CH_3 $. Хвърляне радикал, от своя страна, разцепва хлорен атом от молекулата след $ Cl_2 $ т.н. По този начин, един образуван от радикални посветени много повторения стъпка верига. Броят на повторенията определя дължината на цялата кинетична верижна реакция за хлориране може да достигне $ 10 \ $ 000 или повече.
Решете контрол по всички предмети. 10 години опит! Цена от 100 рубли. период от 1 ден!
Фиг. 6 показва диаграма на енергия хлориране метан.
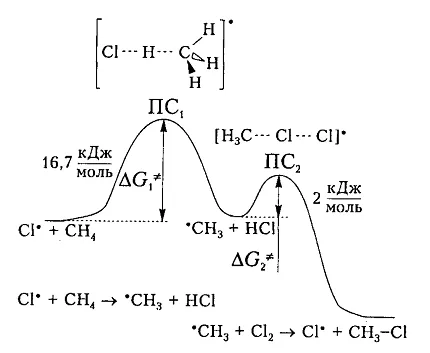
Фигура 6. Диаграма промяна свободен енталпия за взаимодействие хлорен атом и молекула метан
Закони радикал хлориране на метан
Въз основа на теоретични съображения хлор и метан молекула ще взаимодействат един с друг само когато тяхното свободно енталпия е равен на размера на енергия бариера (и активиране енергия) 16,7 кДж / Mol, което винаги е малко по-голяма от разликата (-6 KJ / мола) енергия счупи стария връзка $ СН $ (425 кДж / мол) и образуването на нова връзка - комуникация $ Н-CI $ (-431 кДж / мол). Следователно, не всеки сблъсък взаимодействие частици причинява тяхното взаимодействие, а само тези, които са достатъчни за преодоляване на тази бариера.
Допълнително активиране енергия поради излагане на топлина или молекули. Възбудени молекули проявяват достатъчно висока скорост, кинетичната енергия на който се превръща в потенциална енергия при сблъскване. В горната част на кривата в преходно състояние $ $ PS_1 между взаимодействие компоненти на активен комплекс се образува в които образуването $ С-Н $ и разцепване връзка стар нов $ -С $ възникне приблизително едновременно. Образуваната пропелант радикал има достатъчно потенциална енергия и относително лесно взаимодейства с последващо молекула $ Cl_2 $. Енергията на активиране на този етап е само 2 кДж / мол. Получаване на крайно съединение $ CH_3Cl $ преминава през втория етап на активирания комплекс с преходно състояние $ PS_2 а. $
Решете контрол по всички предмети. 10 години опит! Цена от 100 рубли. период от 1 ден!
Хлорирането на метан и други алкани при температури - процес plohoupravlyaemy които обикновено не спира образуването на метил хлорид $ CH_3C1 $ и може да се получи от:
Фигура 7. хлориране на метан
Йонийски механизъм хлориране на метан
В присъствието на катализатор (Lewis киселини $ A1C1_3 $, $ SbF_5 $), което допринася за механизма за йонна реакция процеса на хлориране в кисела среда има електрофилен характер ($ $ Se). Химията на взаимодействието elektronoaktseptornogo алуминиев хлорид с хлор молекула е по същество поляризация неполярен комуникация $ С-С $, което причинява дисоциационна за образуване на електрофилен агент. Без такива катализатори реакция хлориране йонно едва ли се случва, защото хетеролитична разцепване на молекулата в хлорен катион и анион изисква значителна енергия (1130 кДж / мол).
Хлорирането на наситени въглеводороди в присъствие на катализатори, йонната верига възниква elektrofilnym механизъм ($ Se $):
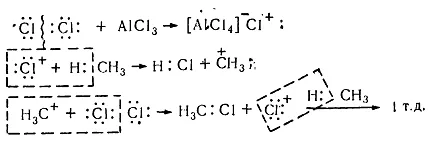
Фигура 8. хлориране на метан