химическата връзка
Доктрината на химичната връзка е в основата на всички теоретичната химия.
При такава химична връзка разбере взаимодействието на атоми, които ги свързва към молекули, йони, радикали. кристали.
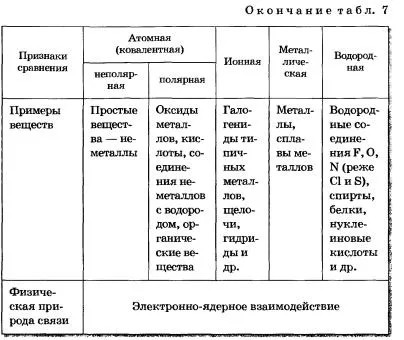
Съществуват четири вида на химически връзки: йонна, ковалентна метални и водород.
Йонната химичната връзка - връзка, образувана чрез електростатично привличане на катиони на аниони.
Както знаете, това е най-стабилната електронна конфигурация на атомите, в която най-външното ниво на електрон, като благородни газове атома, електроните ще бъдат 8 (или за първо ниво на енергия - 2). Когато химичните взаимодействия атоми са склонни да купуват само като стабилна електронен конфигурация и често се постигне това, или чрез добавяне на валентните електрони на други атоми (Процес възстановяване) или в резултат на въздействието на техните валентните електрони (процес на окисление). Атомите присъедини "чужди" електрони се превръщат в отрицателни йони или аниони. Атомите че дарява неговите електрони, превърнати до положителни йони или катиони. Ясно е, че между анионите и катионите на електростатично привличане сила, която ще ги държи един до друг, като по този начин извършване йонна връзка.
Тъй като катиони образуват обикновено метални атоми и аниони - неметални атоми, логично е да се заключи, че този тип връзка е характерно за съединенията с типичен метал (елементи на основната група I и II групи, различни от магнезий и берилий BE) с типични неметалните елементи (елементи на основната група група VII). Класически пример е образуването на халиди на алкални метали (флуориди, хлориди, и т.н.). Да разгледаме например схема за образуване на йонни връзки в натриев хлорид:
Две противоположно натоварени йони, свързани сили на привличане, не губят способността да взаимодействат с противоположно натоварени йони, което води до образуване на съединение с йонна кристална решетка. Йонни съединения са твърди, издръжлив, огнеупорен материал с висока точка на топене.
Разтвори или стопилки мнозинство от йонни съединения - електролити. Този тип връзка е характерно за типични метални хидроксиди и соли на много кислородни киселини. Въпреки това, образуването на йонна връзка възниква идеално (пълна) прехвърляне на електрони. Йонната връзка е краен случай на полярен ковалентна връзка.
съединение йони йонни са представени като под формата на електрически заряди с сферична симетрия на електрическото поле е еднакво намалява с увеличаване на разстоянието от центъра на заряд (йон) във всяка посока. Следователно, взаимодействието на йони е независимо от посоката, която е, йонна връзка, за разлика от ковалентна е индиректно.
Йонна връзка съществува в амониеви соли, където не метални атоми (тяхната роля амониев катион).
Ковалентното химична връзка
Ковалентното химична връзка - връзка между атоми настъпва schaya чрез образуване на общи електронни двойки.
Тя се основава на идеята, също описват придобиването на атоми на химични елементи енергично благоприятна и стабилна Електронната конфигурация на осем електрони (на водороден атом от двете). Такава конфигурация на атомите не получава чрез електронен удар или присъединяване, както в случая на йонна връзка, чрез образуване на общи електронни двойки. Механизмът на образуване на такава връзка може да бъде заменен или донор-акцептор.
Exchange механизъм действа когато атоми образуват двойки електрони споделени чрез комбиниране несдвоени електрони. Например:
Съобщение става чрез образуването на общо S-електронна двойка електрони с водородни атоми (припокриващи S-орбитали):
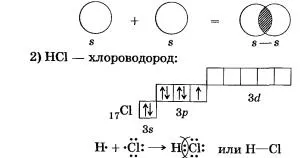
Съобщение става чрез образуването на обща електронна двойка на S- и р-електрони (припокриване S-р орбитали):
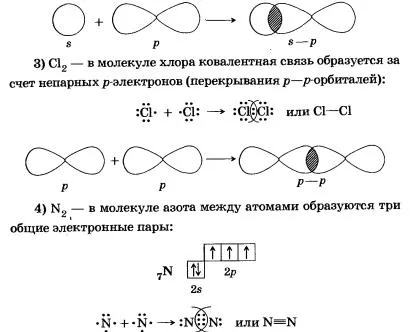
Донор-акцептор образуване механизъм ковалентна връзка, помисли класически пример на образуването на амониев NH4 + йон:
Донор е електронна двойка акцептор - безплатно орбитална, че тази двойка може да отнеме. Свързването на амониев йон с всичките четири водородни атома на ковалентна три образувани чрез създаване на обща електронна двойка на азотен атом и водородни атоми на механизма обмен, един формира механизъм донор-акцептор. Всичките четири връзки N-H в катион еквивалент на амониев.
По същия начин, донор-акцептор връзката в йон метиламониева [SN3NH3] +.
Ковалентни връзки са представени не само от механизма на образуване на електронни двойки споделен свързване атоми, но също така от метода на припокриване електрон орбита-Leu, в зависимост от броя на електронни двойки споделен, и преместването на един от свързаните атоми.
Съгласно метода на припокриване на електрони орбитали разграничи ковалентни връзки сигма и пи.
Молекулата на азот е една обща електронна двойка се формира от сигма връзка (електронна плътност е в област, разположена на линията, свързваща ядрата на атомите; траен връзка).
Две други общи електронни двойки са образувани от I-връзки, което означава, че страничните припокриващи р орбитали в двата региона; пи-връзка-слаба от сигма връзка.
азотни атоми съществува между молекула един сигма-връзка и две пи връзки, които са във взаимно перпендикулярни равнини (от р взаимодействат 3 несдвоен електрон на всеки атом).
Следователно връзка може да се образува в резултат на припокриване на електрони орбитали:
а също и поради припокриването на "чисти" и хибридни орбитали:
SP 2 -SR 2 (С2Н4) и други подобни. г.
По броя на общите електронни двойки, свързващи атома, който е от множеството, изтъкнати ковалентни връзки:
въглероден оксид (IV)
3) терполимери на:
C2H2
HC = CH ацетиленови
По степен на отклонение обща електронни двойки, свързани с един от ковалентна връзка на атоми може да бъде неполярен и полярен. Когато неполярни ковалентни връзки споделени електронни двойки не се изместват към всеки от атомите, тъй като те имат същите електроотрицателност атоми (ЕО) - имот да забави момента валентен електрон на други атоми.
Ковалентна връзка, образувана между въглеродните атоми на същото електроотрицателност, наречен неполярен.
Чрез ковалентна връзки са образувани неполярен молекула-неметални прост вещество.
Стойностите на относителната електроотрицателност на фосфор и водороден са почти идентични: ЕА (H) = 2.1; ЕЕ (F) = 2.1, така че в молекулата фосфин Ph3 връзки между фосфорен атом и ковалентна неполярен водороден атом.
Ковалентна връзка между атомите на елементи, които са различни Електроотрицателност, наречен полярен
Азот - елемент повече електроотрицателен от водород, така че общите електронни двойки се изместват си атом.
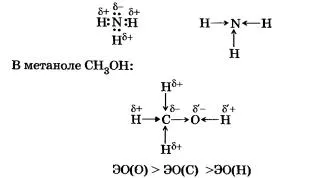
Необходимо е да се направи разграничение на полярността на молекулата и полярността на връзката. Полярността на връзката зависи от стойностите на електроотрицателност на свързани атоми и полярността на молекулата зависи от полярността и геометрията на молекулата. Например, комуникация в молекулата на въглероден диоксид С02 ще бъде полярен и неполярен молекула няма да защото има линейна структура.
Н20 полярен вода молекула, тъй като тя се образува от две полярни ковалентни връзки Н> 0 и има ъглова форма. HOH ъгъл връзка на 104,5 °, така кислородния атом с частичен отрицателен заряд 6 и две несподелени електронни двойки, образувани от отрицателния полюс на молекулата, а водородните атоми на заряда 6+ - положителен. Молекулата на вода - дипол.
Вещества с ковалентна връзка характеризира с кристална решетка на два вида:
Атомна - много издръжлив (диамант, графит, кварц); молекулна - при нормални условия са газове, летливи течности и твърди но топим материал или сублимира (Cl2, Н20, йод I2 «сух лед" С02 и др.).
Вътремолекулната ковалентна връзка е силна, но междумолекулна взаимодействието е много слаба, така че кристалната решетка молекулно е нестабилна.
Съобщение в метали и сплави, които действат относително свободни електрони между металните йони в кристалната решетка на метал, металът се нарича.
Такава индиректно комуникация, ненаситен, характеризиращ се с малък брой на валентните електрони и голям брой свободни орбитали, което е типично за метални атоми. Схема на метален връзката (М - метал):
_
М 0 - СИ <-> Мп +
Наличието на метал връзката причинени от физичните свойства на метали и сплави, твърдост, електрическа проводимост и топлопроводимост, еластичност, пластичност, метален блясък. Вещества с метални връзки имат метална решетка. В своите възли са йони или метални атоми, между които свободно (в кристала) се движат електрони ( "електрон газ").
химичната връзка на между положително поляризирани водородните атоми на една молекула (или част от него) и отрицателно поляризирани атоми силно електроотрицателните елементи, имащи свободна електронна двойка на друга молекула (или част от него) се нарича водород.
Механизмът на образуване на връзка на водород е частично електростатично частично донор-акцептор природата. В тази връзка, дори веществата с ниско молекулно тегло могат да бъдат течни при нормални условия (алкохол, вода) или втечняват лесно газове (амоняк, ftorovodo-род).
На биополимерите - протеини (вторична структура) има вътрешномолекулна водородна връзка между кислорода и карбонил амино водород.
Полинуклеотидна молекула - ДНК (дезоксирибонуклеинова киселина) е двойна спирала, в която двете вериги на нуклеотиди, свързани един с друг чрез водородни връзки. По този начин, на принципа на комплементарност, т.е., тези връзки са образувани между специфични двойки, съставени от пуринови и пиримидинови бази: аденин нуклеотиди срещу (А) е тимин (Т), и срещу гуанин (G) - цитозин (С).
Вещества с молекулно водородна връзка са кристални решетки.
Еднаквото естеството на химичната връзка
Разделянето на видовете химични връзки е условно, тъй като те се характеризират с определено единство.
Йонна връзка може да се счита като ограничаващ случай на полярен ковалентна връзка.
метален връзка комбинира ковалентна взаимодействие с атоми и електрони социализирани чрез електростатично привличане между електрони и метални йони.
Веществата често липсват химичната връзка ограничаване случаи (или "чисти" химични връзки).
Например, литиев флуорид 1lK отнася до йонни съединения. В действителност, тя призовава на 80% и 20% йонна ковалентна. Правилно е така, очевидно, се говори за степента на полярност (ionicity) химична връзка.
Сред халогениди HF - хидрохлоридна - НВг - HI - Nat степен на полярност намалява поради, за намаляване на разликата в електроотрицателност стойности от халогенни атоми и водород, и водород Astatide комуникация става почти неполярен (ЕО (H) = 2.1; ЕА (Аг) = 2.2).
Различни видове връзки могат да се съдържат в една и съща вещество, например:
1) в базите - между атомите на кислород и водород в gidroksogrupp ковалентна връзка полярен и между метала и gidroksogrupp - йон;
2) с киселина соли на кислород - неметални атоми между киселинната част и кислород - полярен ковалентна между метал и киселинен остатък - йон;
3) амониеви соли, метиламониев т.н. - между атомите на азот и водород - полярен ковалентно, и между йон-E и амониев или метиламониева киселинен остатък - йон ..;
4) метални пероксиди (например, Na2 О2) - връзка между ковалентна неполярни кислородния атом и между метал и кислород - йон, и др ...
Различни видове връзки могат да преминават един на друг:
• когато електролитната дисоциация на вода ЛИЗАЦИЯ ковалентна съединения полярен ковалентна йонна връзка става;
• изпаряване на метали се превръща в метален ковалентна връзка неполярен и т. D.
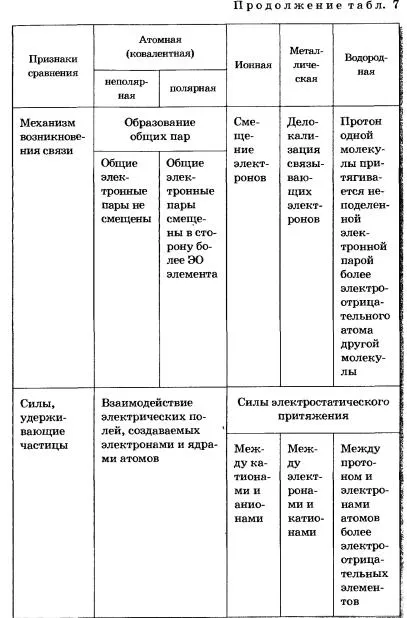
Причината за единството на всички типове и видове химични връзки е от същия физически характер - електрон-ядрени взаимодействия. Образуването на химичната връзка във всеки случай е резултат от електрон-ядрен атома взаимодействия, придружен от освобождаването на енергия (таблица. 7).
ТАБЛИЦА 7 Chemical Съобщение Видове

1. Често има една поговорка: ". Молекулите на елементарните благородни газове" Що се отнася до това отговаря на истината?
2. Защо, за разлика от повечето елементи, неметални, най-видните представители тях - халогени - никаква форма на алотропна модификации?
3. Оставете най-пълно характеризиране на химичната връзка в молекулата на азот с помощта на следните признаци: ЕО свързани атоми, механизмът на образуване, метода на припокриване на електрони орбитали комуникация множество.
4. Определяне на вида на химичното свързване, и да видим неговото формиране съединение в материали, имащи формулата: Са CaF2, F2, БЗ 2.
5. Добави структурни формули на веществата: CO, CaC2, CS2, FeS2. Определяне на окисляване състоянието на елементите и техните валентността (в възможни случаи) за тези вещества.
6. Докажете, че всички видове химични връзки имат общ произход.
7. Защо молекулите N2, СО и C2H2 наречени изоелектронен?
Ако имате корекции или предложения на този урок, моля свържете се с нас.
Ако искате да видите и другите корекции и предложения за уроци, погледнете тук - Образователен форум.