Ензими, терапевтична стоматология
Ензимите плака са били предмет на задълбочени проучвания само в последното десетилетие. Най-основната работа на изследването са били извършени от скандинавски учени.
Изследване на ефекта на протеази плака хемоглобин, естери на α-1-амино-1, и поли-амино киселина показват, че скоростта на хемоглобин хидролиза е в пряка зависимост от концентрацията на суспензия от зъбна плака и хемоглобин. Оптималното рН за хидролизата на хемоглобин е 7.5-8.0. Хидролиза тозил-аргинин-метил естер е максимална при рН 10,1. Също така този субстрат, протеаза смила плака ВАЕЕ (етилов естер бензоил-аргинин) и ATEE (етилов естер на ацетил-тирозин). Наред с това, лесно смилаем полилизин протеаза с оптимално рН 9-10. В същото време, ензими плака, за разлика от пепсин, папаин, трипсин, фицин, поли-1-глутаминова киселина не разцепват.
С чрез гел филтрация върху Sephadex G-100 и G-200 на човешка зъбна плака бяха изолирани две протеази, една от които е активен срещу желатин, а вторият заедно с желатин лесно отцепена хемоглобин. Първият протеазата има молекулно тегло около 200000, оптималната рН 8,5 и се активира от калциеви йони. Вторият протеаза има молекулно тегло 40 000-50 000, оптималното рН за разцепване на хемоглобина и 7.8 също активира от калциеви йони. Както протеаза лесно инактивира продължение на 5 минути, докато се нагрява до 70 ° С
Ако допълнително пречистване на протеази избрани провежда с използване зона електрофореза получава високо пречистени ензими. Първият, с високо молекулно тегло, лесно разцепва поли-1-лизин, докато вторият ензим не действа по този субстрат. Както протеаза смила желатин, активиран лауриламин и в по-малка степен натриев флуорид; инхибитори на тези ензими е EDTA, лаурил (особено втория протеаза) и инхибитор на соев трипсин. Двете протеази показват максимална стабилност между рН 3,5-8,5
Използване заедно с Sephadex агарозен оставя да се открие присъствието на трети протеиназна активност към хемоглобина и желатин. Тази протеаза има молекулно тегло в диапазона от 40 000-50 000.
По-късно в получената плоча открити 4 група на протеолитични ензими, които са разделени един от друг чрез гел филтрация върху Sephadex G-100. Използвайки метода на изоелектрично фокусиране на плака бяха изолирани протеолитични ензими, имащи изоелектрични точки PL 4, 4.6 5.9, 6.8. Молекулното тегло на тези ензими е в границите от 20 000-150 000.
Плаката бе открита човешки ензими, е изключително лесна за разцепване на а- и бета-L-нафтиламид ppolina и L-хидроксипролин (Mäkinen, 1969). В допълнение към тези специфични пептидази също са подчертани неспецифично пептидаза лесно разцепва нафтиламид L-аланин, L-метионин, L-левцин и L-фенилаланин. Този неспецифичен пептидаза инактивира лесно parahlormerkuriybenzoatom. Всички изследвани naftilamidazy синтезира лактобацили.
Плакет събрани при деца с гингивит има протеолитична активност 5 пъти по-голяма от тази на здрави деца. Въпреки това, тези разлики може да се дължи на неравномерно количество плака при деца на здравите и болните гингивит.
Изследването на качествен състав на протеолитични ензими, изолирани от зъбна плака на деца и възрастни, показва липса на функциите на хроматографския профил на тези ензими.
Изследвания хиалуронидаза в плака е от особен интерес поради факта, че този ензим е способен да разцепва хиалуронова киселина - основния извънклетъчен вещество на съединителната тъкан - и по този начин увеличаване на пропускливостта на последната. Най-дълбоката и най-изчерпателно изследване на хиалуронидаза плака бяха проведени група от шведски учени. Използване Вискозиметрия метод, намериха хиалуронидазна активност в човешка зъбна плака и се изследва някои от неговите свойства. Значителна промяна на ензимната активност при хора. Ензимът има две оптимално рН 5,5 и 6,5, което показва присъствието на повече от една изоформа. Когато гел филтрация върху Sephadex G-200 е показано наличието на два пика имат хиалуронидазна активност. Интересно е да се отбележи, че плочата хиалуронидазното е относително стабилен при температура от 0 ° С 4-4, но много зле понасят замръзване. По този начин, след 12 дни съхранение при 4 0 ° задържа над 60% от първоначалната хиалуронидазна активност, докато при температура от 0 ° С -20 - само около 11%. С чрез гел филтрация върху Сефадекс и Биогел открити няколко форми на хиалуронидаза в зъбната плака. Почти всички от тях има оптимално рН 6,5; първият връх имаше допълнителен оптимална при рН 5. Интересна особеност е относителното ензим хиалуронидаза термоустойчивост първия връх, докато вторият пик различава аварийно thermolability.
Методите за фракциониране на соли, йонообменна хроматография на А-50 гел филтрация DEAE-Sephadex на Биогел, izozlektricheskogo фокусиране и две последователни гел филтрация на препарат Биогел получава хиалуронидаза, пречистени от 14 до 500 пъти с добив 4.4%. Хиалуронидазен плака е микробен произход, като в макрофагите и тъкани kostnoi офлайн хиалуронидазна активност при рН 6,5, въпреки че има съответна активност при рН 3,5-4.
С помощта на изоелектрично фокусиране на човешка зъбна плака са два различни хиалуронидаза изолира, чиито свойства са много сходни с хиалуронидаза, изолиран от култура зъбна плака. Оптималното рН за първия ензим е 5-5,2, и за втората - 6.2. И двата ензима са най-стабилни при стойност на рН 5-8, те са бързо инактивиран при температура над 50 ° С Намерени са тези ензими 4 фракции с молекулно тегло 300 000, 200 000, 150 000 и 100 000.
Източникът на плочата на хиалуронидаза, както е посочено по-горе, са микроорганизмите с най-активните производители на хиалуронидаза се стафилококус ауреус и Streptococcus mitis, и аеробни и анаеробни Corynebacteria. Всички други видове микроорганизми, способни да продуцират този ензим.
Оптималното рН на хиалуронидаза е в интервала 5,1-6,2, изоелектричната точка е 8. хиалуронидаза е стабилен при рН стойности от 5-9, а термолабилни ензим.
При пациенти с диабет и гингивит намерено много висока хиалуронидазна активност на зъбната плака.
В човешки плаки установено присъствието на лизозим. Около 70% от лизозим активност се концентрира в утаечни фракция на плака. Ензимът има оптимално рН 5,1, като човешки лизозим, много стабилна и в рамките на два дни не променя тяхната активност при тази стойност на рН. Лизозим плака активност различни предмети варира до голяма степен. Източникът на лизозим плака, по всяка вероятност, е слюнката. Използване на изоелектрично фокусиране лизозим изолира в пречистена състояние; представлява един изо-форма, за разлика от настоящето на лизозим в левкоцити. В проучването на лизозим активност в динамика плака за учредяване се установява, че тази дейност е най-малко плака съзряване има тенденция да намалява.
В допълнение към тези ензими са в плака фосфатаза, невраминидаза, лактат дехидрогеназа, и редица други ензими на гликолитичен път разграждането на глюкоза.
С хроматографски метод на човешки зъбна плака няколко фракции, изолирани фосфатази хидролизират паранитрофенил фосфат. Ензимите са с рН оптимум 5,6, и имат много значителна стабилност в широк диапазон на рН. В безклетъчна фракция на човешка зъбна плака открива кисела (с оптимално рН 5,5) и се алкализира (с оптимално рН 8,5) фосфатаза източник на тези фосфатази, по всяка вероятност, са микроорганизми.
Streptococci supragingival плака продукция dekstranglyukozidazu (декстраназа), способен при меки киселинни условия за отцепване на глюкоза от декстран.
В човешки плаки намери-амилаза, glitseralde-gidfosfatdegidrogenaza, лактат дехидрогеназа, глюкоза-6-фосфат дехидрогеназа, сукцинат дехидрогеназа, glutamatdegidrogenaza, lipoamide дехидрогеназа и глутатион пероксидаза, oksibutiratdegidrogeneza, малат дехидрогеназа, изоцитрат дехидрогеназа, phosphogluconate дехидрогеназа, пероксидаза, дезоксирибонуклеаза I, РНКаза и плазмин.
Ние установихме, че активността на плака ензими (кисела или алкална фосфатаза, алкална протеаза, катепсин рН 3.5) варира по време на нейното развитие, както може да се види от фиг. 3, кисела фосфатаза активност бавно и леко намалена в първите 8 часа за образуване на плаки е значително намалена 12 часа през нощта, но до края на ден значително увеличава неговата активност.

Картината е подобна алкална фосфатаза, за които нощ (12 часа) се характеризира с най-ниското ниво на активност. Плаката сглобени в продължение на 24 часа, активността на този ензим е много висока. Активността на алкалната протеаза се увеличава постепенно, достигайки максимум до края на деня, докато katepticheskaya активност, напротив, има тенденция да намалява постепенно.
Резултатите от определяне на ензимната активност в зъбната плака (1-9 дни), при нормални условия на доставка, са показани на Фиг. 4.
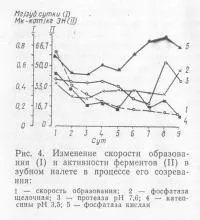
Данните показват, че активността на кисела фосфатаза, като достига високи стойности в първия ден, по време на втората и трета ден значително намален, а повече се увеличава последователно, достигане на максималните стойности на 8-ия ден. Активността на алкалната фосфатаза в 2- 3-ти ден, а след това спад от 4 до 8-ми ден, тя се съхранява на едно и също ниво, там е малко по-различна от стойността си в 1-ви ден, а само на 9-тия ден от резки покачвания , Активността на алкалната протеаза има максимални стойности на образуване на първия ден плака и след това постепенно намалява до 7-ия ден. През този период на ензимната активност е почти два пъти по-ниска от първоначалната си стойност. Дейност ка-tepsinov рН 3,5 по всяко време има тенденция да намалява, а най-ниската стойност за този ензим са наблюдавани на 9-тия ден.