Ентропията е лесно!
Този пост е безплатен превод на отговора, че Марк Eichenlaub даде на въпроса Какво е интуитивен начин да се разбере, ентропия?. посочен на сайта Quora
Ентропия. Може би това е един от най-трудните за разбиране концепции, с които можете да се срещнат в хода на физиката, поне когато става дума за класическата физика. Малко завършилите физическите факултети могат да обяснят какво е то. Повечето от проблемите, свързани с разбирането на ентропия, обаче, могат да бъдат отстранени, ако сте разбрали едно нещо. Ентропията е качествено различен от другите термодинамични количествата: като налягане, обем, или вътрешна енергия, тъй като тя не е собственост на системата, и как ние гледаме на тази система. За съжаление, в хода на термодинамиката това обикновено се третира наравно с други термодинамични функции, което допринася за недоразумение.
Така че това, което е ентропията?
С две думи, на
Ентропия - така много информация не знаете за системата
И какво, ако ти кажа, че сумата е равна на 59? За тази macrostate има само 10 възможни microstates, така че е ентропията само един символ. Както можете да видите, различен имат различен macrostate ентропия.
Сега нека ви кажа, че сумата на първите пет костите 13, а сумата на останалите пет - 17, така че общият размер на над 30. Трябва, обаче, в този случай повече информация е на разположение, така че ентропията на системата за вас трябва да падне. И, наистина, 13 в пет кости може да получи 420-то по различни начини, и 17-780-то, което означава, че общият брой на microstates за обикновен 420h780 = 327 600. ентропията на такава система е приблизително един знак по-малко, отколкото в първия пример.
Ние измерваме ентропията на броя на знаците, необходими за записване на броя на microstates. Математически, това се определя като логаритъм от броя, така че символът, обозначаващ ентропия S, както и броя на microstates символ на w, ние можем да напишете:
Това е нищо друго освен формула Болцман (до фактор к, което зависи от избраната мерна единица) за ентропията. Ако macrostate отговаря на едно microstate, ентропията от тази формула е нула. Ако има две системи, общият ентропията е равна на сумата на ентропията на всяка от тези системи, защото дневник (AB) = A + влизане влизане Б.

От описанието доведе горе става ясно, защо ние не трябва да мислим за ентропия като свои собствени системи за собственост. Системата има opedelonnye вътрешна енергия, импулс, такса, но тя не разполага с определен ентропия: ентропията десет костите зависи от тяхната известна само на вас цялата сума, или също частични суми кости петици на.
С други думи, ентропията - това е начина, по който се опише системата. И това го прави много по-различен от останалите количества, които правят работата по физика.
Физическа например: газа под буталото
Класическа система се обработва по физика, е газ, съдържащ се в съда под буталото. Microstate газ - тази позиция и скорост (скорост) на всеки от своите молекули. Това е еквивалентно на това, че знаете смисъла на това падна на всяка кост в нашия пример по-рано. Macrostate газ е описано такива количества, налягане, плътност, обем, химически състав. Това е сборът от стойностите на навитите заровете.
Количества, описващи macrostate могат да бъдат свързани помежду си чрез така наречената "уравнение на състоянието". Наличието на тази връзка позволява, без да знае microstates да се предскаже какво ще се случи с нашата система, ако започнете да се нагрява или да се движи буталото. За идеален газ уравнение на състоянието е проста:
Въпреки, че най-вероятно ще бъдат по-запознати с Клапейрон - Менделеев PV = νRT - това е едно и също уравнение, с добавянето на един чифт от константи, за да ви обърка. Колкото повече microstates, съответстващи на дадена macrostate, т.е. повече частици са част от нашата система, толкова по-добре състоянието на уравнението го описва. За типичните стойности за броя на газовите частици са номер на Авогадро, т.е. от порядъка от 23 октомври.
стойности на налягането тип, температура и плътност се нарича осреднени като са осреднени проявление непрекъснато последователни Microstates съответстващи на тази macrostate (или по-скоро в близост до него macrostates). За да научите microstate в който се намира на системата, ние имаме много информация - ние трябва да знаем позицията и скоростта на всяка частица. Размерът на тази информация се нарича ентропия.
Как промяната на ентропията на macrostate? Лесно е да се разбере. Например, ако имаме малко топлина на газа, това ще увеличи скоростта на частиците, следователно, ще се увеличи степента на нашето невежество за скоростта, което е увеличение на ентропията. Или, ако се увеличи обемът на газ чрез натискане на буталото, за да се повиши степента на нашето невежество на позициите на частиците, и ентропията също расте.
Твърди и потенциална енергия
Ако ние считаме, вместо газ всяко твърдо тяло, най-вече с подредена структура на кристали, например, парче метал, ентропията е ниска. Защо? Защото знае позицията на атомите в една такава структура, и вие знаете позицията на всички останали (те са подредени в правилна кристална структура), скоростта на атомите е малък, тъй като те не могат да летят далеч от мястото си и само леко се люлее около равновесното положение.
Ако парче метал се намира в гравитационното поле (например, повишава над повърхността), потенциалната енергия на всеки атом в метала е приблизително равна на потенциалната енергия на други атоми, и свързани с тази ниска ентропия енергия. Това отличава потенциалната енергия на кинетичната енергия, която за топлинно движение може да варира от атом с атом.
Ако парче метал, доведена до определена височина, нека отиде, а след това нейната потенциална енергия се превръща в кинетична енергия, но ентропията се увеличава почти няма, защото всички атоми ще се движат приблизително същата. Но когато едно парче пада на земята по време на въздействието на металните атоми, за да получите случаен посока и ентропията се увеличи драстично. Кинетичната енергия на насочено движение отива в кинетична енергия на термично движение. Преди да удари някои знае как се движи всеки атом, сега сме загубили тази информация.
Ние разбираме, вторият закон на термодинамиката
Вторият закон на термодинамиката гласи, че ентропията (затворена система) винаги се увеличава. Сега можем да разберем защо: защото не можете изведнъж да получите повече информация за microstates. Веднага след като загуби част от информацията за microstate (и двете по време на удара парче метал на земята), не можете да я върне.

Да се върнем към заровете. Спомнете си, че macrostate със сумата от 59 има много ниска ентропия, но също така да получите това не е толкова лесно. Ако хвърлите заровете отново и отново, те ще изпаднат от сумите (macrostate), които отговарят на по-голям брой microstates, че ще се изпълнява с голям macrostate ентропия. Най-големият ентропията има общо 35, и че тя ще падне повече от другите. Това е за него, и вторият закон на термодинамиката. Всяка произволна (неконтролирано) взаимодействие води до увеличаване на ентропията, поне докато достигне своя максимум.
смесване на газове
И още един пример за да се определи каза. Да предположим, че има контейнер, в който има два газ, разделени с преграда се намира в центъра на контейнера. Нека да наречем една единствена молекула газ синьо, а другото - червено.
Ако отворите дял, газ ще започне да се бърка, защото броят на microstates, в която се смесват газовете, много повече, отколкото microstates, в които те са разделени, както и всички microstates, разбира се, също толкова. Когато се отвори дял, ние сме загубили информацията от коя страна на преградата е сега за всяка молекула. Ако молекули са N, N загуби информационните битове (бита или символи тук, това е всъщност същото, и се различават само по някои постоянен коефициент).
Ние разбираме с демон на Максуел
И накрая, помислете за решение, тъй като част от нашата парадигма на известния парадокс на демон на Максуел. Позволете ми да ви напомня, че това е, както следва. Нека имаме смесени газове от сините и червените молекули. Поставете обратно дял, след като направи това в една малка дупка, в която растенията въображаемия демон. Неговата задача - да се премине от ляво на дясно само червено и синьо от дясно на ляво само. Очевидно е, че след известно време газовете отново са разделени: всички сини молекули ще бъдат оставени на стените, както и всички червени - в дясно.
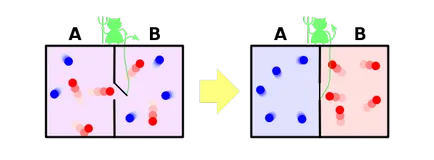
Оказва се, че нашият демон понижава ентропия на системата. Тъй като нищо не се случи демон, тоест, ентропията не е променен, но системата е затворена в нашата страна. Оказва се, че ние открихме един пример, където на втория закон на термодинамиката не е доволен! Както се оказа, че е възможно?
Ние се реши този парадокс, обаче, е много проста. След ентропия - този имот не е система, а нашите знания за системата. Всички знаем за системата е малък, така и ние мислим, че ентропията намалява. Но нашият демон знае за системата много - за разделяне на молекули, той трябва да знае позицията и скоростта на всеки един от тях (най-малко се доближава до него). Ако той е наясно с всички молекули, които от своя гледна точка, ентропия на системата, в действителност, е нула - тя не трябва липсващата информация за него. В този случай, тъй като ентропията на системата е равна на нула и остава нула и втория закон на термодинамиката никога не безпокоят.
Но дори и ако демонът не знае цялата информация за microstate на системата, тя е най-малкото, че е необходимо да се знае цвета на молекулата лети до него, за да се разбере, да я подаде, или не. И ако общият брой на молекулите е N, демонът трябва да има N бита информация за системата - но тя е толкова много информация и загубихме, когато е отворена преграда. Това означава, че количеството информация, загубил е точно равна на сумата на информация, за да бъде получена информация за системата, за да го върне в първоначалното си състояние - и това звучи доста логично, и, отново, не противоречи на втория закон на термодинамиката.