Електролити и техните свойства - Chemistry
Прочетете повече: Силни електролити. йон дейност
Водни разтвори на соли, киселини и основи притежават някои функция - те провежда електричество. Така безводни твърди соли и основи, както и безводни киселини не провеждат ток; почти не провежда ток, и чиста вода. Очевидно е, че когато са разтворени във вода такива вещества се подлагат на някои дълбоки промени, които определят електропроводимостта на разтворите, получени.
Например, когато ток преминава през разтвор на сярна киселина, вода се разлага на съставните си части - водородът и кислородът се разви на плаките, свързани съответно към положителните и отрицателните полюси на батерията. Този вид решения са химически разграждащи се, когато ток минава през тях, ние ще се нарича електролити, както и процесът на разпадане вещества електрически ток - електролиза.
1. Определяне на електролити
Може да се каже, че електролитите - вещество, което съдържа значително концентрация на йони, които допринасят за преминаването на електрически ток (йон проводимост). Електролити се наричат също проводници от втория вид.
В тесен смисъл електролити - вещество, чиито молекули в разтвор, поради електролитна дисоциация, дисоциират на йони. Сред твърдите електролити се разграничават, електролитни разтвори и йонни стопилки. Електролитни разтвори са често наричани също електролити. В зависимост от вида на електролити разтворителя се разделят на водни и не-водни електролити. За специален клас от електролити с високо молекулно тегло включват - полиелектролити.
В съответствие с естеството на йоните, образувани чрез електролитна дисоциация на водни разтвори, солта се изолира електролити (в които не йони Н + и ОН -) киселина (Н + йони преобладават) и основа (основно йони ОН -). Ако молекулна дисоциация на електролитни катиони брой е равен на броя на аниони, такива електролити се наричат симетричен (1,1 -valent, например, калиев хлорид, 2,2-валентна, например, CaSO4. И т.н.). В противен случай електролити наречен асиметрични (1,2-валентни електролити, напр. H 2SO 4. 3,1-валентна, например А1 (ОН) 3, и т.н.). В зависимост от способността на електролитна дисоциация на електролитите условно разделени на силните и слабите страни. Слабите електролити се характеризират главно с постоянна и степента на дисоциация, и силни йони активност.
1.1 Слаби електролити. Постоянно и степен на дисоциация
Молекули слаби електролити само частично дисоциират на йони, които са в динамично равновесие с молекули nedissotsiiruyuschimi. Слабите електролити включват много органични киселини и основи във водни и неводни разтворители. Степента на дисоциация зависи от естеството на разтворителя, концентрацията на разтвора, температурата и други фактори ( <1). Один и тот же электролит при одинаковой концентрации, но в различных растворителях образует растворы с различной степенью диссоциации.
Разтворите на слаби електролити, равновесие е установено между недисоциираните молекули и продукти от тяхното разпадане - йони. Например, установено в равновесие воден разтвор на оцетна киселина
SNzSOON + Н + СН3СОО -
Чиито константа (константа на дисоциация), свързани с концентрациите на съответните частици от отношението:
Степента на дисоциация на електролит, както се нарича част от молекули, подложени на дисоциация, т. Е. съотношението на броя на молекулите в разтвора разложен на йони от електролита на общия брой на молекули в разтвор.
Ако MX електролит дисоцииране на йоните на М + и X- и постоянна степен на дисоциация са свързани (право на разреждане)
където С - моларна концентрация на електролита, моловете / литър.
Ако степента на дисоциация е значително по-малко от един, а след това можем да вземем приблизителното изчисление, че 1 - А1. Тогава закон израз по-лесно разреждане:
Последното показва, че съотношението разтвор при разреждане (т. Е. С намаляване електролит концентрация C) степента на дисоциация на увеличенията на електролита.
Ако степента на неговото дисоцииране е, концентрацията на йони в разтвор и X- М + са еднакви и включват електролитен разтвор на MX:
Заместването на стойност от горното равенство, намираме:
За изчисления, свързани с разпадането на киселини, често е удобно да се използва от постоянна К и т.нар индекс на дисоциационната константа рКа е даден от
Очевидно е, че с увеличаването на К, т.е. с увеличаване на силата киселина, стойността рКа намалява ..; Следователно, по-голямата рКа, по-слабата киселина.
Когато се прилага в слаб електролитен разтвор на подобни йони (т. Е. йони идентичен с един от йони, получени чрез дисоциация на електролита), равновесието на дисоциация е нарушена и измества в посока на образуване на недисоциираните молекули, така че степента на дисоциация на електролита намалява. Следователно, добавянето на разтвор на оцетна киселина, соли (например, натриев ацетат) ще се увеличи концентрацията на йони СН3СОО - и, в съответствие с принципа на Le Шателие, равновесието на дисоциация се измества наляво.
SNzSOON + Н + СН3СОО -
В разтвори на многоосновни киселини, както и бази, съдържащи няколко хидроксилни групи, са определени етапи равновесие, съответстващи на последователните етапи на дисоциация. По този начин, дисоциация на фосфорна киселина се провежда в три етапа, всеки от които съответства на определена стойност на постоянна скорост на дисоциация. От K1 K2 >> >> K3. след това продължава в най-голяма степен на дисоциация на първия етап, а преминаването към всеки следващ етап, степента на дисоциация като цяло се намалява драстично.
Разпадането на електролита води до факта, че общият брой на разтворените частици (молекули и йони) се увеличава в сравнение с разтвор на nonelectrolyte същата моларна концентрация в разтвора. Поради свойствата на които зависят от общия брой частици в разтвор на разтвореното вещество (colligative свойства) - като осмотично налягане, понижаване на налягането на парата, точка на кипене височина, замразяване депресия точка - възникне в електролитни разтвори в по-голяма степен, отколкото в еднаква концентрация разтвори на не-електролити. Ако в резултат на дисоциация на общия брой частици в разтвора на електролита се повишава от I пъти в сравнение с броя на молекулите, трябва да се вземе под внимание при изчисляване на осмотичното налягане и други colligative свойства. Формулата за изчисляване на намаляването на налягането # 8710; стр разтворител пара става в този случай както следва:
p0 - парното налягане над чист разтворител;
n2 - брой молове от разтворено вещество;
N1 - брой молове от разтворител;
аз - Van't Hoff фактор или коефициент Van't Hoff.
Подобно понижаване температурата на кристализация # 8710; tkrist и увеличаване на температурата на кипене # 8710; е дадено от електролитния разтвор В.Р.
където m - molal концентрация на електролита, и К и Е - съответно cryoscopic постоянно и непрекъснато разтворител ebullioskopicheskaya.
Накрая, за да се изчисли на осмотичното налягане (Р, кРа) електролитен разтвор като се използва формулата
където С - моларна концентрация на електролита, мола / литър; R - константа газ (8,31 мола J -1 К -1.). Т - абсолютната температура, К.
Лесно е да се види, че факторът Van't Hoff и може да бъде изчислена като съотношение # 8710; стр. # 8710; tkrist. # 8710; точка на кипене. P намерен от опит на същата стойност, изчислена с изключение на електролитна дисоциация (# 8710; rvych. # 8710; tkrist.vych, # 8710; tkip.vych, Rvych):
Изотоничен коефициент и свързани със степента на дисоциация на електролита и съотношението
където К - брой на йони в който молекулата е при дисоциацията на електролита (KCl за к = 2, за BaCl2 и Na 2SO 4 к = 3, и др ...).
Така, от експерименталните стойности намерено # 8710; стр # 8710; .. и т.н. tkrist стойност аз, ние можем да се изчисли степента на дисоциация на електролита в разтвора. Трябва да се има предвид, че в случай на силни електролити намери по този начин стойността и изразява само "очевидно" степен на дисоциация, както и в разтвори на силни електролити дисоциира изцяло. Наблюдаваната разлика между видимата степента на дисоциация на единици, свързани с йон-йонни взаимодействия в разтвор.
Прочетете повече: Силни електролити. йон дейност
Информация за работата на "Електролити и техните свойства"
Категория: химия
Брой знаци с интервалите: 73378
Брой на таблици: 4
Брой снимки: 1

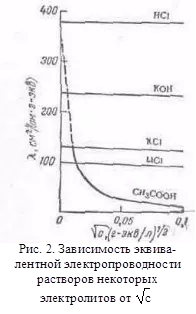


с други разтворители, смятаме, че rennye модели се съхраняват, но има отклонения от тях, например на криви # 955 С често се наблюдава най-малко (ненормално електрическа проводимост). 2. Мобилността на йони се сдружават електролит проводимост при скорост на движение на ТА на нейните йони в електрическо поле. За да се изчисли Elektroprom-проводимост достатъчно, за да се преброят на йони.

с възстановяване кислород - липсата на кислород. С въвеждането на електронен представителства химия реакции концепция окислително-редукционни са разширени до реакция, при която не участва кислород. В неорганична химия редокс реакция (IAD) може официално да се разглежда като изместването на електрони от един атом на реагент (редуциращо средство) към друг атом (.

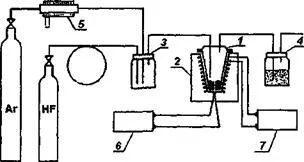

изследването на синтеза на нови материали и йон транспортни процеси в тях. В чиста форма, такива модели могат да се различат по-ясно в изследването на единичен кристал твърд електролит. В същото време, използването на твърди електролити като работната среда функционални елементи трябва да се вземе предвид, че материалите се нуждаят от определен вид и форма, като плътна керамика.
17-25 кг / тон на стипца-ЛИЗАЦИЯ че
10-15 кг / м-висока от резултатите за диалуминиевият куче-chanogo. Двуалуминиевият триокис се използва за производството на алуминий, да съдържа минимално количество железни съединения, Silica, тежки метали с по-нисък потенциал за освобождаване на катода от алуминий, тъй те са лесно и преходи-DYT в алуминиев катод. Нежелателно, тъй като присъствието инча