електрохимични клетки
При пускането на метален цинк в меден сулфат разтвор ще редокс реакция:
Както половината реакция (редукция и окисление) случи едновременно в мястото на контакт с разтвор на цинк. Цинк дава два електрона катион мед се окислява в същото време.
Ако направим обратното и вкара меден метал в цинков сулфат разтвор, след това нищо няма да се случи. Дръжте метал дейност! Цинкът е по-активен от мед - тя губи електрони по-лесно.
В горния пример, както половината реакция протича в едно място. А какво ще стане, ако се разделят намаляване наполовина реакция и окисление? В този случай, електроните ще се движат от редуктора към окислителя чрез външен кръг, който ще служи като проводник на електрически ток. Да - реж електронен поток е нищо, тъй като електрически ток.
Устройство преобразуване на химическата енергия в електрическа енергия, наречена клетка. или, с прости думи, - електрическите батерии.
1. Даниел Element
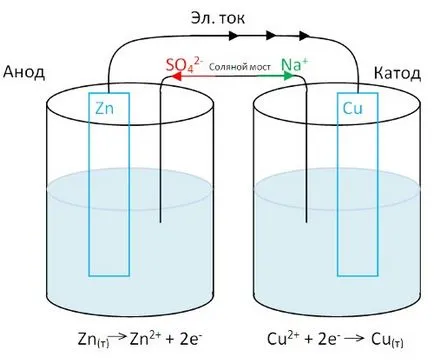
Медна плоча (отрицателен електрод - анода), потопена в контейнер на меден сулфат.
Цинк плоча (положителен електрод - катод) - разтвор на цинков сулфат.
Плаките са свързани помежду си от метален проводник. Но за да се покаже на електрически ток във веригата, е необходимо да се свърже капацитет сол мост (тръба, запълнена с концентриран солев разтвор). Сол мост позволява йони да се премине от един съд в друг, разтворите остават електрически неутрални. Какво се случва със системата?
Цинк окислява: цинкови атоми стават йони и преминават в разтвор. Освободените електроните се движат през външна верига на мед електрод, където намаляването на медни йони. Входящите електроните тук, свързани с отнемане от разтвор на медни йони. В тази форма на медни атоми, се изолира като метал. Катиони сол мост се премества в съда с мед електрод да замени консумативи медни йони. Анионите на мост сол се преместват в контейнер на цинков електрод, което помага да се поддържа електрически неутрален разтвор, получен с цинкови катиони.
Потенциална разлика (напрежение) в такава система ще бъде по-голям, по-нататъшните метали са разделени един от друг в активността на ред.
2. Химическо клетка
електрически клетъчна батерия домакинство сухо се използва, състояща се от:
- цинков корпус (анод);
- разположен в корпуса на графит прът (катод).
Прътът е заобиколен от слой от манганов оксид и сажди, се използва като електролит слой на амониев хлорид и цинков хлорид. В резултат на това се появят следните реакции:
В алкална сух клетка вместо киселинен хлорид се използва като електролит на алкална среда калиев хидроксид, което увеличава живота на клетката, защото Корпуса не корозират толкова бързо
Основният недостатък на електрохимични клетки, е фактът, че производството на електроенергия е толкова дълго, докато в края на един от реагентите.
3. Батериите
Батерии елиминират Основният недостатък на сухи клетки - кратък живот, тъй като те могат да се презареждат, но поради тяхната експлоатация време се увеличава много пъти и е на няколко години.
Общата олово батерия се състои от шест серийно свързани, елементи (кутии). Всяка банка дава 2V напрежение, както и тяхната сума = 12V.
Кабелът се използва като анод. Катод - оловен диоксид (PbO2). Електродите се потапят в разтвор на сярна киселина (H 2SO 4). Когато се прави контакт, следните реакции протичат в батерията:
Батерия (с непокътнато състояние на превозното средство) служи само за стартиране на двигателя. Отправната точка в пистите на веригата на значително текущите (десетки ампера), така че да изтощи батерията много бързо (за няколко минути). След стартиране на двигателя, всички подаването на захранване от автомобил поема генератора. По време на работа на генератора на двигателя зарежда батерията: първоначалните окислително-редукционни реакции протичат в обратна посока:
В резултат на извличане на олово и оловен диоксид.
4. галванопластика
Същността на електролитни клетки е да се приложи поради електрически химични реакции - възстановяване на катода и окислението на анода.
Реакцията на редокси срещащи се в електродите чрез преминаване на електрически ток през електролитната клетка се нарича електролиза:
Електролитни елементи се използват за галванично. Така един тънък слой от метал прилага към повърхността на друг метал.
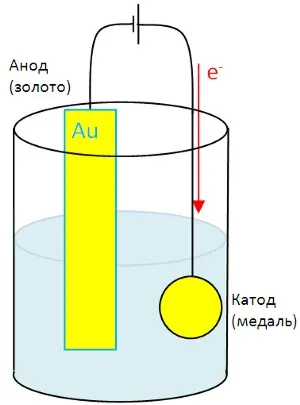
външен източник на енергия е източник на ток с галванични. Бар на злато е източник на златни йони, които са намалени в повърхността на монета.
Покрития депозират чрез електролиза са получени в чист и издръжлив дебелина. В резултат на това, продуктът изглежда по-различно от "чисти" версия, а цената - много по-евтино.