Дехидриране субстрат и водород окисление (образуване на H2O) като източник на енергия за синтеза на АТФ
Наименование: дехидрогениране субстрат и водород окисление (образуване на H2O) като източник на енергия за синтез на АТФ. NAD и FAD-зависима дехидрогеназа, убихинон дехидрогеназа, цитохром и цитохром
Специализация: биология и генетика
Описание: Електроните с висок енергиен потенциал предава от намалени коензими НДХ FDH2 и кислород чрез транспортер верига локализиран във вътрешната мембрана на митохондриите. Те катализира тип реакция: RCHOHR1 ND↔ RCOR1 НДХ Н. Въпреки това, с възможност за включване на електрони NDPH СРЕ чрез действието на пиридин нуклеотидната трансхидрогеназа катализира реакцията: NDPH ND NDP НДХ. Чрез FMNsoderzhaschim ензими принадлежат NDHdegidrogenaza който също е локализиран във вътрешната мембрана на митохондриите; това.
Размер на файла: 152,07 KB
изтеглен на работа: 14 души.
Дехидриране субстрат и водород окисление (образуване на Н 2О) като източник на енергия за синтез на АТФ. NAD и FAD-зависима дехидрогеназа, убихинон дехидрогеназа, цитохром и цитохром оксидаза.
Енергията, освободена по време на ензимно окисление метаболити специфични дехидрогенази. В дехидрогениране реакции, електрони и протони се прехвърлят от органични субстрати и коензими NAD- FAD-зависими дехидрогенази. Електроните с висок енергиен потенциал, предавани от намалени коензими NADH и FADH2 кислород чрез верижни транспортьори локализирани във вътрешната мембрана на митохондриите. Възстановяване O2 молекули се появява в резултат на електронен трансфер 4. Всяка свързваща кислород-2 електроните, пристигащи от него средство за пренос на веригата, се абсорбират от матрицата 2 протони, като по този начин се образува молекула на H2O.
Окисляване на органична материя в клетки е придружено от консумацията на кислород и вода синтез, наречен тъкан дишане. и веригата на електронен транспорт (СРЕ) - дихателната верига.
Електроните, които влизат в CPE, тъй като те се движат от един превозвач на другата губят свободната енергия. Голяма част от тази енергия се съхранява под формата на АТФ, и част от енергията се разсейва като топлина. Освен това, електроните с висок енергиен потенциал, в резултат на окисляването на различни субстрати могат да бъдат използвани в реакции на биосинтеза, за които добавянето на АТР изисква намаляване еквивалента, като NADPH.
Прехвърлянето на електрони от окислените субстрати на кислород се среща в няколко етапа. В това включва голям брой междинни вектори, всеки способна да прикачи електрони от предходния компонент и за предаване на следващия. Тъй като има верига на редокси реакции, което води до възстановяване възникне O2 и H2O синтез. На митохондриалната респираторна верига включва голям брой носители.
Освен убихинон (KoQ), всички компоненти на СРЕ - протеини. Като част от тези белтъци съдържат различни не-протеинови компоненти: FMN, Fe в състава на желязо-серни протеини и състояща се от порфиринови пръстени Cu йони.
Основно водород акцептори. Основно акцептори реакция водород редокси дължи на два вида: дехидрогенази nikotinamvdzavisimym. коензими, съдържащи като производни на никотинова киселина и flavinzavisimym. производни, съдържащи рибофлавин.
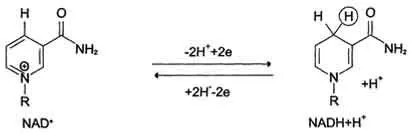
Nikotinamidzavisimye дехидрогеназа съдържа като коензими NAD + или NADP + (вж. Раздел 2). NAD + и NADP + - производни на витамин PP. Тези коензими са част от активните центрове дехидрогеназата, но може да бъде обратимо дисоциират от комплекса с apofermentami и включени в ензима по време на реакцията. Субстрати NAD- и NADP-зависими дехидрогенази са разположени в митохондриалния матрикс в цитозола. Работна част от никотинамид коензим е никотинамид.
Повечето дехидрогенази, доставящи електрони крайните потребителски устройства съдържат NAD +. Те катализира от вида на реакция:
R - СНОН - R 1 + NAD + ↔ R - СО - R 1 + NADH + H +.
По този начин, NAD +, поставяне на протони и електрони от различни субстрати, служи като основните енергия колектор окисляващи вещества и основен източник на електрони с висок енергиен потенциал, за СРЕ. NADPH не е директна донор на електрони в СРЕ, и се използва почти изключително в регенеративен биосинтеза. Въпреки това, с възможното включване на електрони в NADPH СРЕ чрез действието на пиридин нуклеотидната трансхидрогеназа катализира реакцията:
NADPH + NAD + ↔ НАДФ + + NADH.
Флавин дехидрогеназа съдържат като коензими FAD или FMN. Тези коензими са оформени в тялото на витамин В2. Флавин коензими силно свързани с apofermentami. Работа част на FAD и FMN е izoalloksazinovaya конюгат пръстенна система.
FAD е електронен акцептор на много субстрати в реакции от типа:
R-СН2-СН2-R1 + E (FAD) ↔ R-СН = СН-R1 + E (FADH2),
където Е - протеин част на ензима.
Повечето от FAD-зависима дехидрогеназата - разтворими протеини локализирани в митохондриалния матрикс. Изключение е сукцинат дехидрогеназа, разположен във вътрешната митохондриална мембрана. За FMN, съдържащи ензими принадлежат дехидрогеназа NADH, което също е локализиран във вътрешната мембрана на митохондриите; го окислява NADH, която се образува в митохондриалния матрикс.
електронна транспортна верига от NADH и FADH2 за трансфер на кислород електрони от NADH до О 2 включва множество носители, които са локализирани във вътрешната мембрана на митохондриите. Освен убихинон и цитохром С, този комплекс протеинови комплекси.
Дехидрогеназа NADH (NADH-Q-редуктаза комплекс I) се състои от няколко полипептидни вериги. Ролята на протеза групата играе FMN. Единственият ензимен субстрат - NADH, два от които електрона и предаването на протонната за образуване на FMN FMNH2. Вторият протона се абсорбира от матрицата. Реакцията протича съгласно уравнението:
NADH + H + + е (FMN) → NAD + + E (FMNH2)
С FMNH2 електрони след това прехвърлени в редица желязо сяра протеин (FeS), играе ролята на втория протезна група в молекула дехидрогеназа NADH. Атомите на желязо в тези протеини (не-хем желязо) са събрани в няколко групи, така наречените желязо сяра центрове. FES центрове са част от много протеини (флавопротеини цитохроми), участващи в окислително-редукционни реакции. Има 3 вида FES центрове (FeS, Fe2S2, Fe4S4), при което желязо атом е свързан към серен атом на цистеинов остатък или неорганична сяра. NADH дехидрогеназа Fe2S2 съдържа няколко типа центрове и Fe4S4 железни атоми в такива центрове могат да приемат и даряват електрони от своя страна, преминавайки в железен (Fe2 +) и фери (Fe3 +) състояние. От желязо сяра центрове електрони се прехвърлят на коензим Q (убихинон).
Определяне на този мастноразтворими хиноновото съставено от първите букви на английските имена на хинонен (хинон) и име убихинон отразява широко разпространена в природата (повсеместно - повсеместна). Убихинон молекула в зависимост от източника, от който те са разпределени, се различават по дължина на веригата, което при бозайници съдържа 10 изопреноидни единици и е посочена като Q10. Процесът на електронен трансфер от NADH-дехидрогеназа да убихинон чрез FeS това обратимо превръща хидрохинон. Убихинон извършва колектор функция закрепване електрони от NADH-дехидрогеназа и други дехидрогенази flavinzavisimyh по-специално чрез сукцинат дехидрогеназа. Убихинон участва в реакциите на типа:
Е (FMNH2) + Q → E (FMN) + QH2.
Цитохроми или хемопротеини присъстват във всички видове организми. В еукариотни клетки, са локализирани в митохондриалните мембрани и в ER. Има около 30 различни цитохроми. Всички цитохроми като протезна група, съдържаща хем. Тяхното разнообразие се дължи на:
- разлика в структурата на темата на странични вериги;
- разлика в структурата на полипептидните вериги;
- разлика в начина на комуникация с хема полипептидни вериги.
В зависимост от способността да абсорбира светлина при определени дължини на вълните на светлината всички цитохроми са разделени в групи А, В, С. В рамките на всяка група, отделните видове с уникални спектрални свойства представляват индекси (б, В1, В2, и т.н.).
Структурни особености на различните видове цитохроми определят разликата им в окислително-редукционни потенциали. цитохроми на СРЕ 5 тип състоеше (а, A3, В, С, С1). Освен цитохром с, цитохром разположени във вътрешната мембрана на митохондриите под формата на сложни протеинови комплекси.
QN2 дехидрогеназа (коензим Q-цитохром с D uktaza комплекс III) се състои от 2 вида цитохроми (В1 и В2) и цитохром С1. QN2 дехидрогеназа трансфери електрони от убиквинол цитохром с. Вътре в комплекс III електрони се прехвърлят от цитохром Ь на FES центрове, цитохром С1, последвано от цитохром с. тема Group, като Фес-центрове, носи само един електрон. Така, от QH2 молекулата 2 електрони се прехвърлят към 2 молекули на цитохром Ь. Като междинен продукт в тези реакции електронен транспорт, могат да образуват свободни радикали SE-mihinona. В цитохром Ь тип хем не е ковалентно свързан с протеин, и цитохроми С1 и е прикрепен към протеина чрез тиоестерни връзки. Тези връзки са образувани чрез свързване на две цистеинови остатъци на виниловите групи на хем.
Цитохром С - водоразтворима периферна мембранен протеин с молекулно тегло от 12 500 D има единична полипептидна верига от 100 аминокиселинни остатъци, и хем молекула, ковалентно свързана към полипептида.
Цитохром оксидаза (комплекс IV) се състои от 2 вида цитохроми Aa3 всяка от които има свързващ сайт с кислород. Цитохроми един и a3 имат характеристика zhelezoporfirinovuyu протезна група хем наречените А и различни от хем цитохроми С и С1. Той съдържа формил група вместо метилова група и въглеводородна верига на мястото на един от винилови групи. Друга особеност на комплекс-A3 - наличието в него на медни йони, свързани към протеин в така наречената astyu Cua центрове. Прехвърлянето на електрони и а3-комплекс включва реакцията:
Cu + ↔ Cu2 + + д, Fe2 + ↔ Fe3 + + напр.
Комплексът цитохром а-a3 реагира директно с молекулен кислород.
