Cheat - елементи от периодичната г блок
1. химичните свойства и биологичната роля elementovd блокира
К г -блок включва 32 елементи на периодичната система. Те са разположени в страничните подгрупи 4-7 на периодичната система в големи периоди между s- и р-елементи.
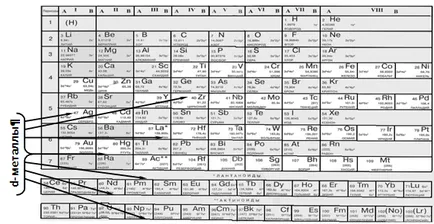
Характерна особеност на г-блокови елементи е, че техните атоми не последна пълни орбитали на външния слой (както в S- и р-компоненти) и predvneshnego [(М - 1) г] слой. В тази връзка, в г-валентна елементи са енергично близо девет орбитали - един NS-орбитални три NP външни орбитали и пет (п - 1) г-орбиталния енергийни нива predvneshnego:
Структурата на външни електронни черупки от атоми, описани с формула г блок (п-1) га NSB. където а = 1
2. Общи harakteristikad елементи
В периоди (вляво) с увеличаване на ядрената заряда на радиуса на атом бавно увеличава непропорционално на броя на електроните, които заемат на атома.
Причини - lanthanoid компресия и проникването NS електрони по г-електронен слой (в съответствие с принципа на минималната енергия). Възниква екраниране основни заряд външната валентните електрони за елементите на 4-ти период на външните електрони проникне екран 3d-електронна подслой, докато елементите на шестия период - 4f екран и 5d електроните (двойно пресяване).
В периода на (отляво надясно) се наблюдава намаление на йонизационна енергия, електронно сродство енергия. Тъй като промяната на енергията йонизация и електрон афинитета са незначителни, химичните свойства на елементи и техните съединения се различават малко.
В групи (надолу) с увеличаване на атомен заряд ядро увеличава енергията йонизация, относителните електроотрицателност елементи (OEO) растат метални и киселинни свойства, свойства на потребителя понижено метални.
3. алкално-киселинното и редокс свойства и тяхното изменение
D-блокови елементи са в III, IV, V, VI, VIIB групи имат непълна г-електронна слой (predvneshny ен. Level). Тези електронен слой са нестабилни. Това обяснява променлива валентност, както и възможността да се показват различни степени на окисление на D-елементи. Окислителни г-блокови елементи в съединенията са винаги само положителни.
Съединения с по-висока степен на окисление проявяват киселинни и окислителни свойства (в разтворите представени кислородни аниони). Съединенията с по-ниски степени на окисление - намаляване и основни свойства (представени с катиони в разтвора). Съединения с междинно окисление - показват амфотерни свойства.
В периода с увеличаване атомен заряд ядро намалява стабилността на съединенията с най-висока степен на окисление увеличава техните окислителни свойства.
В групи увеличава стабилността на съединенията с най-висока степен на окисление се увеличава и намалява свойства за намаляване на окислителни елементи.
4. Redox svoystvad елементи в човешкото тяло
Поради разнообразието на степени на окисление химия 3D-елементи типична реакция редокси.
На свой ред, способността на 3D-елементи да се променя степента на окисление, в качеството на окислител или редуциращи средства, е в основата на голям брой на биологично важни реакции.
В хода на еволюцията, природата опцията е избрана за степента на окисление, че те нито са силни оксиданти и силни редуциращи агенти.
Да бъдеш в човешкото тяло г-елементи в най-високата окисление възможно, само ако тези елементи са слаби окислително-редукционни свойства.
Например, Mo + 6 в комплексни съединения в организма в тялото има състоянието окисляване 5 и 6.
Катиони Fe + 3 и Cu + 2 в биологични течности не проявяват намаляване свойства.
Наличието на съединения в долната окисляване оправдано за организма. Йоните Mn + 2, Co + 2, Fe + 3 при рН на физиологични течности не са силни редуциращи агенти. Околните лиганди стабилизират йони в тези окисление.
5. Комплексообразуващи sposobnostd елементи
Възможност за създаване на химически връзки, включващи D-електрони и свободни г-орбитали причинява силно изразена способност на г-елементи в образуването на стабилен комплекс съединения.
При ниски окисление на D-елементи на типична катионен, докато при високи - анионни осмостенно комплекси.
елементи D-КН са подвижни, е четно число от 4 до 8, най-малко 10,12.
Използване незапълнени г-орбитали и самотен двойки електрони на г-електронна слой predvneshnem, D-елементи са в състояние да действа като донор на електрони - сменяем връзка. и електронни акцептори.
Осмостенно структура на комплексообразуващ йон се определя от способността на орбитите до хибридизация на d2 sp3. Например, за хром (III), d2 sp3 хибридизация е както следва:
D-комплекси Bioinorganic елементи към протеинови молекули, наречени biocluster. Biocluster разположен вътре в кухината, където металният йон е с определен размер, размера на йон трябва да съответства точно на диаметъра на biocluster на кухината. Метал реагира с донорни атоми свързващи групи: -ON хидроксил, сулфхидрил -SH, -SOO¯ карбоксил, амино протеини или аминокиселини - NH2.
Biocluster, кухините на които образуват центровете на ензими, наречени металоензими.
В зависимост от функцията, изпълнявана biocluster обикновено са разпределени в:
- транспорт, доставят кислород на тялото и biometals. Добри транспортни форми m / метални комплекси, използвани AMC. Както координиране метал може да бъде: Co, Ni, Zn, Fe. Например - трансферин.
- акумулатор. спестявания. Например - миоглобин и феритин.
- биокатализатори и активатори инертни процеси.
Реакциите катализирани от тези ензими са разделени на:
На киселина-основа реакцията. Карбоанхидразата катализира обратимата процес хидратация СО2 в живите организми.
Катализирана металоензими, в която металът обратимо промени окисление.
А. Карбоанхидразата, карбоксипептидаза, алкохол дехидрогеназа.
Карбоанхидразата - Zn, съдържащ ензим. Кръв ензим в червените кръвни клетки. Карбоанхидразата катализира обратим процес хидратация СО2, и катализира реакцията на хидролиза, в които карбоксилна група се включва субстрат.
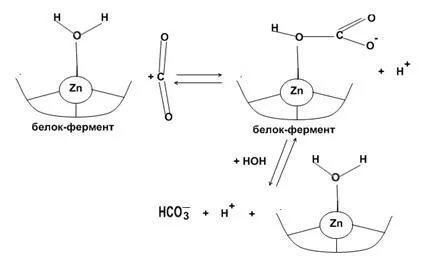
СО2 + Н 2О ↔ Н 2СО 3 ↔ Н + + HCO3- ¯ (механизъм на "цинк-вода")
На ↔ СО2 + HCO3 ¯ (механизъм на "цинков хидроксид")
Номерът на координация на 4. Три цинкови координационни места заети от аминокиселини, четвърто орбитални свързва вода или хидроксилна група.
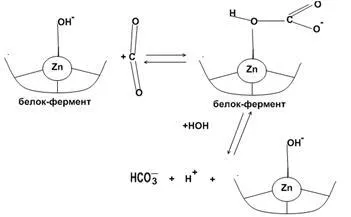
Обратимо хидратация на СО2 в активното място на карбоанхидраза
Карбоксипептидаза Zn, съдържащ ензим. концентрация обекти са черен дроб, черва, панкреас.
Участва в хидролизата на пептидни връзки.
Схема карбоксипептидаза цинк взаимодействие със субстрата ( "цинк-карбонил"):
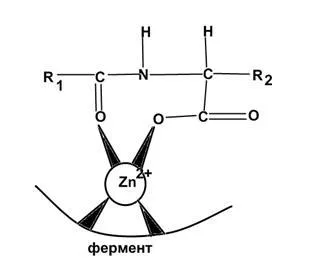
Реакционна схема хидролиза на пептидни връзки karboksipetidazy:
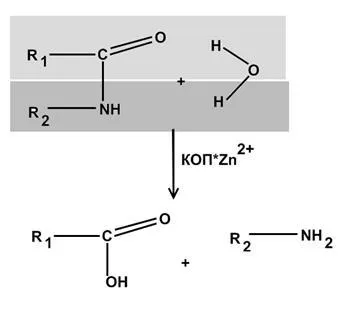
съдържащ алкохол дехидрогеназа е ензим.
Б. цитохроми, каталаза, пероксидаза.
Цитохром С (виж лекция COP). Heme съдържащ ензим, има осмостенно структура.
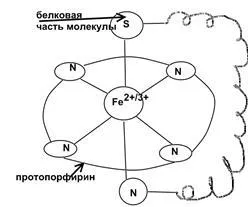
електронен трансфер в редокс верига с ензима се извършва чрез промяна на състоянието на желязо:
Църквата на Христос * Fe3 + + E ↔ Църква на Христос * Fe2 +
група от ензими, които катализират окисляването vodorodperoksidom наречен каталаза и пероксидаза. Те имат в тяхната структура хем централната атом е Fe3 +. Лиганд среда е представена в случай на каталаза AMC (хистидин, тирозин), в случай на пероксидаза - лиганди са протеини. Концентрираните ензими в кръвта и тъканите. Каталаза ускорява разлагането на образувана в резултат на метаболитни реакции водороден прекис:
Н 2О 2 + Н 2О 2 ↔katalaza ↔ 2 Н 2О + O2
пероксидаза Ензимната ускорява окисляването на органични вещества (RH) на водороден прекис:
Н 2О 2 + Н 2О * RH ↔peroksidaza ↔ 2 Н 2О + RCOOH
SOD - супероксид дисмутаза - мед-съдържащи протеин. Той ускорява реакцията на супероксид йон разлагане, свободен радикал. Този остатък се внасят в взаимодействие с компоненти стойка го унищожава. SOD превръща супероксид йон на водороден пероксид. Което, от своя страна, се разлага в организма чрез ензима каталаза.
Схематично, процесът може да се представи:
Лазерно - оксигеназа - активиране на ензими кислород молекула, която участва в процеса на окисление на органични съединения. Оксигеназа двата кислородни атома са свързани за образуване на пероксидни вериги.
механизъм оксигеназите на действие могат да бъдат обобщени, както следва:
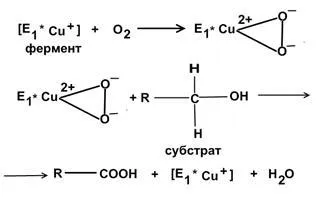
Цитохром оксидаза - CCO - най-важният дихателните ензима.
Катализира последния етап на тъкан дишане. По време на процеса на каталитично окисление мед CCO обратимо променя: Cu2 + ↔Cu1 +.
Окислена форма на CCO (Cu2 +) получава електрони, които се движат в редуцирана форма (CU1 +), окисляем с молекулен кислород, се по този начин възстановява.
След това, кислород получава протони от околната среда и се превръща във вода. Схема на действие на CCO:
Церулоплазмин - CPU - мед-съдържащ протеин се открива в плазмата на бозайник. Процесорът 8 включва медни атома на една молекула на протеин. CPU е включен в оксидацията на желязото:
Успоредно с това, окисление процеса протонирани субстрати (RH) за образуване на свободни радикали междинни съединения:
В същото време, процесорът катализира редукцията на кислород във водата:
O2 + 4Е + 4Н + → → 2Н2 О CPU
Извършване транспортна функция, процесорът регулира баланса на мед и осигурява отстраняване на излишната мед от тялото.