Бинарните съединения - е това, което
Бинарните съединения - са вещества, които се формират от два различни химически елементи. Този термин се използва, когато се отнася до качествения и количествен състав на неорганични съединения.
Binary химично съединение се счита за важен въпрос в изследването на естествени вещества. Като описва следните определения се използват: връзка поляризация, степента на окисление валентност. Тези химически условия позволяват да се разбере същността на химичната връзка, структурни елементи на неорганични вещества.
Разглеждане на основни класове на двоични съединения, по-специално тяхната химическа структура и свойства, някои области на промишлено приложение.

Този клас неорганични вещества е най-често срещаните в природата. Сред най-известните представители на тази група съединения да се направи:
- силициев оксид (речен пясък);
- водород оксид (вода);
- въглероден диоксид;
- глина (алуминиев оксид);
- железни руди (железни оксиди).
Такова съединение двоично - комплекс вещество в състава, който се изисква кислород присъства, показващи степен на окисление -2.
Физически държавни оксиди
Съединенията от мед, калций и желязо са кристални твърди вещества. Подобно състояние на агрегиране някои неметални оксиди като шествалентен сяра, Пентавалентните фосфор, силиций. Течен при нормални условия, е вода. По-голямата част от кислородни съединения на неметалните елементи са газове.
образователни функции
Тези двоични съединения - са продукти на вулканична активност, както и като компонент на минералната вода. Въглеродният диоксид не поддържа горенето, обаче, това химическо съединение се прилага за гасене на пожари.
Летливи водород съединение
Такова съединение двоично - е важна група от вещества, състоящи се от настоящето на водород. Сред представители с промишлено значение, бележка, метан, вода, сероводород, амоняк и водородни халиди.
Част от летливи водородни съединения, присъстващи в почвата вода, живите организми, така че може да се говори за тяхната геохимичното и биохимични роли.
За да двоични съединения от този тип, на първо място, представляват водород, имащи валентност. Тъй като вторият елемент се подава на неметални има отрицателно състояние окисление.
За индекси подравняване в двоични съединение валенции определен между най-общо кратно. Броят на атомите на всеки елемент се определя чрез разделяне на валентността на всеки елемент, представляващ съединението.
Хлороводород
Разглеждане на двоични съединенията с формула: водороден хлорид и амоняк. Тези вещества са от значение за съвременната химическа промишленост. Солна киселина при нормални условия е газообразен съединение е добре разтворим във вода. След разтваряне на газообразен хлороводород се образува, солна киселина се използва в много химични процеси и производствени вериги.
Това двоичен съединение, съдържащо се в стомашния сок на хора и животни, е пречка за патогени, проникваща храната в стомаха.
Сред основните приложения на хлориди солна киселина се изолира препарат, синтез на хлорирани продукти, ецване метални тръби пречистване от окиси и карбонати, производство на кожа.
Амоняк, имащо формулата NH3. е безцветен газ с особен остра миризма. Неговата неограничена разтворимост във вода произвежда амоняк, настоя в медицината. В природата, този двоичен съединение се образува по време на разпадането на биологични продукти, в който структурата на азот.

класификация на оксиди
двоичен съединение на метал с валентността на 1 или 2 окислително, е основният оксид. Например, тази група включват оксиди на алкални и алкалоземни метали.
Оксиди на неметалните и метали с валентност по-голяма от 4 са киселинни съединения.
В зависимост от химичните свойства на представители на този клас е разделен на солеобразуваща група и nesoleobrazuyuschie.
Сред типични представители на втората група споменава въглероден окис на (CO), азотен оксид 1 (NO).
Образуване на систематични наименования на съединения
Сред задачите на предложените завършващите връщане на държавен изпит по химия, и има "Създаване на молекулна формула възможно двоичен кислородни съединения сяра (азот, фосфор)." За да се справи с тази задача, трябва да имате представа не само за алгоритъма, но също така и за особеностите на номенклатурата на класа на неорганични вещества.
При формиране на двоични съединенията тук първоначално посочва елемент, който е надясно във формулата чрез прибавяне на суфикса "ID". На следващо място, посочва името на първия елемент. За ковалентна съединения, добавени конзоли, които могат да установят количествено съотношение между компонентите на двоичен съединение.
Например, SO3 - серен триоксид, 2O 4 - диазотен тетраоксид, I2 CL6 - хексахлорид диод.
Ако двоичен съединение е химичен елемент, който може да показва различни степени на окисление, името на съединение в скоби посочват степента на окисление.
Например, две железни съединения се различават по име: FeCl3 - железен оксид (3), FeCl2 - железен оксид (2).
За хидриди, по-специално неметални елементи са тривиални имена. Така, Н2 О - вода, HCL - хлороводород, HI - йодоводород, HF - флуороводородна киселина.
Положителните йони на елементите, които са способни да образуват само една стабилна йон, дават същото име като това на самите символи. Те са всички членове на първа и втора групи на периодичната таблица.
Например, натриеви и магнезиеви катиони имат формата: Na +. Mg2 +. Елементите на преход са способни да образуват няколко типа катиони необходими следователно в заглавието да посочи валентност изложени във всеки случай.
В прост (моновалентен) и комплекс (многоатомни) аниони използвани -id наставка.
Често срещан елемент е oksoanionami специфичен наставка -АМИНО. За oksoanionami елемент намира във формулата с по-ниска степен на окисление се прилага -um наставка. За минимална степен на окисление се използва хипо префикс и за максималната стойност - пер-. Например, йон О 2- е оксид-йон и О - - пероксид.
Съществува голямо разнообразие от тривиални имена на хидриди. Например, N2 Н4 хидразин повикване и повикване фосфин PH3.
Сулфа oxoanions имат следните имена:
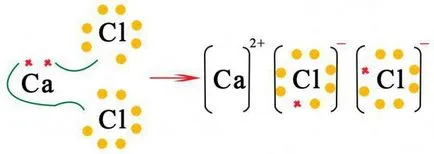
Много от крайните тестове в областта на химията предлага работа: ". Направете формула на двоични метални съединения" Ако съставът на такива съединения е хлорен анион, бром, йод, такива съединения са посочени като халогениди, посочени клас от соли. При изготвянето на тези двукомпонентни съединения с формули в първото място метал се поставя, и след съответния халид йон.
За определяне на броя на атоми на всеки елемент са най-малките сред множество валентности, се получава чрез разделяне на индексите.
Такива съединения с висока температура на топене и температурата на кипене, добра разтворимост във вода, при нормални условия, те са твърди вещества. Например, натриеви и калиеви хлориди, включени в състава на морска вода.
Готварска сол са използвали хората от древни времена. В момента използването на тази бинарна съединение не е ограничена до употреба в храни. В електролиза на воден разтвор на натриев хлорид се получава метален натрий и хлор газ. Тези продукти се използват в различни промишлени процеси, например натриев хидроксид на хлороводород.
Стойност двоични съединения
Тази група включва огромно количество материал, така че можем да кажем със сигурност, за мащаба на тяхното използване в различни сфери на човешката дейност. Амонякът се използва в химическата промишленост като прекурсор в производството на азотна киселина, производство на торове. Това е тази двоичен съединение се използва в фин органичния синтез, отдавна се използва в хладилни системи.
Благодарение на уникалната твърдостта на волфрамов карбид, това съединение се използва в производството на колектора на режещия инструмент. Химическа инертност на двоичен съединение позволява използването му във враждебна среда: лабораторно оборудване, фурни.
"Райски газ" (азотен оксид 1) в смес с кислород се използва в медицината за обща анестезия.
Всички двоични съединения имат ковалентна или йонен характер на химичната връзка, молекулна, йонни или атомно решетка.

заключение
При получаване на съединенията с формули двоичен необходимо да се спазват определена последователност от действия. Първо запис елемент, който проявява положителен окисление (има минимално количество електрическа негативизъм). При определяне на стойностите на степента на окисление на втория елемент се изважда от номер осем група, в която се намира. Ако получените числа се различават един от друг, най-малкото общо кратно се определя, след индекс, изчислен.
В допълнение към оксиди на тези съединения се класира карбиди, силициди, пероксиди, хидриди. алуминий и калциев карбид се използва за лабораторни получаване на метан и ацетилен, пероксиди са използвани в химическата индустрия като силни окислители.
Халид, такъв като водороден флуорид (флуороводородна киселина), когато се използва в електрически запояване. Сред най-важните бинарни съединения, без които е трудно да си представим съществуването на живите организми, което води вода. Характеристики на структурата на неорганични съединения са изследвани подробно в хода на училище химия. Това беше по примера й момчета да получите идеи за екшън сцените в подготовката на формулите на бинарни съединения.
В заключение, че е трудно да се намери сфера на съвременната индустрия, районът на човешкия живот, където и да се използва голямо разнообразие от бинарни съединения.

7 трагична любовна история, която доведе до появата на призраци Любовта е вечна - тя е дори и след смъртта. Ние ще ви разкажа за тези романи, седемте най-трагичните любовни истории, които са довели до появата.

