аз модула
Радикална-функционални алкохоли и замяна номенклатура.
алкохоли име на заместване IUPAC имена, получени чрез прибавяне на съответните алкани затваряне "стари"; чрез радикална - функционална име номенклатура, образувана от името на съответния радикал с добавянето на края "-ovy алкохол."
Номерирането на главната верига започне до края, което е по-близо до групата OH.
В зависимост от, в която въглеродният атом е хидроксилна група, се прави разграничение между първичен (1-пропанол), средно (2-пропанол) и третичен (2-метилпропанол-2) алкохоли.
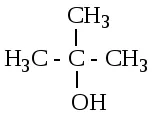
1-пропанол 2-пропанол 2-метилпропанол-2
Изомерия алкохоли.
За алкохоли, характеризиращ се със структурни изомери:
Изомерия въглеродна верига;
Позиционни изомери на функционална група.
Физични свойства на алкохоли. Водородна връзка.
Първите представители на хомоложна серия от алкохоли - течни, висши алкохоли - твърдите вещества. Липсата на газови молекули алкохоли обяснено способност да образува водородни връзки. Първите представители на алкохоли (метанол, етанол, пропанол) са смесими с вода във всякакво съотношение поради образуването на водородни връзки с водните молекули. С увеличаване на молекулното тегло разтворимост във вода алкохоли намалява рязко. По-високите алкохоли са практически неразтворими във вода.
Нисши алкохоли имат характеристика алкохолно мирис, вкуса хомолози средно силна и неприятна. По-високите алкохоли са практически без мирис и третични алкохоли имат неприятна миризма на плесен.
Алкохоли имат ненормално високи точки на кипене в сравнение с алкани, етери, тиоли. Тези разлики са обяснени с наличието на междумолекулни връзки в молекулите на алкохол.
Механизмът на образуване на междумолекулни връзки.
кислороден атом в молекулата на алкохол има висока Електроотрицателност и издърпва електронната плътност на водородния атом. където водородният атом възниква δ +. и кислороден атом δ -. Следователно, водород електростатично привлечени към кислородния атом на друга молекула и водородно свързване настъпва между тях. Молекули, свързани помежду си чрез водородни връзки за образуване сътрудници.
асоциирани степен, тъй като увеличава теглото на алкохола и намалява нестабилността му. С цел да се прекъсне тези връзки изисква допълнителна енергия, и това се дължи на високата температура на кипене.
Най-голямата склонност да образуват водородни връзки показват първични алкохоли. За вторични и третични алкохоли, по-специално способността да се свързват намалена водородно свързване възпрепятстват разклонени въглеводородни радикали.