аморфни твърди вещества
Аморфните твърди вещества в много от техните свойства и главно на микроструктурата трябва да се разглеждат като високо преохлажда течност с много висок вискозитет. Структурата на тези органи се характеризира само с малък обхват, за по подреждането на частиците. Някои от тези вещества, които не са в състояние да кристализира: восък, червен восък, смола. Друг режим на охлаждане на предварително определена форма кристални структури, но в случай на бързо охлаждане инхибира растежа на вискозитет в режим подреждане на частиците. Веществото се втвърдява преди процеса на кристализация се осъществява. Те се наричат стъкловидно тяло: стъкло, лед. Процесът на кристализация в такова вещество може да се появи и след втвърдяване (стъкло помътняване). Аморфно твърдо вещество и включва органични материали: гума, дърво, кожа, пластмаси, вълна, памук и копринени влакна. Процесът на преминаване на тези вещества от течната фаза към твърда е показано на фиг. - крива I.
Аморфни органи имат втвърдяване температури (топене). Графиката на Т = F (т) има инфлексна точка, която се нарича точка на омекване. Понижаването на температурата води до постепенно повишаване на вискозитета. Такъв характер на прехода в твърдо състояние, причинява липса на аморфни вещества топлина специфичен топене. Обратната прехода, когато топлината се подава, има гладка омекване в течно състояние.
Кристално твърдо вещество.
Характерна особеност на микроструктурата на кристалите е пространствен периодичността на вътрешните електрически полета и повторяемост в местоположението на кристални частици - атоми, йони и молекули (дълъг ред гама). Частиците се редуват в определен ред по прави линии, които се наричат възли. Във всеки раздел кристал равнина две пресичащи се линии такива системи образуват множество идентични паралелограми който плътно без празнини обхващат раздел равнина. В пространството на пресечната точка на три не-копланарни системи такива линии образува пространствена решетка, която разделя на кристала в множество идентични паралелепипеди. линия пресечната точка, образувайки кристалната решетка се наричат възли. Разстояния между възли по някаква посока, наречена преводи или решетъчните периоди. Паралелепипед изработена три не-копланарни излъчва се нарича единична клетка или паралелепипед решетка повторяемост. Важен геометрична имот симетрията на кристални решетки в подреждането на частици по отношение на определени посоки и самолети. Поради тази причина, въпреки че има няколко начина за избиране на единичната клетка на кристалната структура на това, че е избрано така, че да съответства на симетрия на решетката.
Кристална тялото могат да бъдат разделени на две групи: единични кристали и polycrystals. За единични кристали наблюдавани в обема на единична кристална решетка на цялото тяло. Въпреки че външната форма на един вид монокристали може да бъде различен, ъглите между лицата, винаги ще бъдат едни и същи. Характерна особеност на единични кристали е анизотропия на механични, термични, електрически, оптически и др. Свойства.
Единични кристали често се срещат в естествено състояние в природата. Например, повечето от минерали - кристал, антракс и рубина. В момента в производството на много единични кристали отгледани изкуствено от разтвори и се топи - скъпоценни камъни, германий, силиций, галиев арсенид.
Един и същ химичен елемент могат да образуват няколко различни по геометрия, кристални структури. Това явление се нарича - полиморфизъм. Например, въглерод - графит и диамант; лед пет модификации и други.
Подходящи външни режещи и анизотропни свойства обикновено не се появяват на кристални твърди вещества. Това се дължи на факта, че кристални твърди вещества обикновено се състоят от много малки кристали произволно ориентирани. Тези твърди вещества се наричат поликристален. Това се дължи на механизма за кристализация: когато необходимите условия за този процес, кристализация огнища едновременно се срещат в множество места на началната фаза. Населените кристали са разположени и ориентирани един спрямо друг е напълно произволно. Поради тази причина, в края на процеса се получи твърдо вещество под формата на конгломерат кондензиран малки кристали - кристалите.
От енергийна гледна точка, разликата между кристални и аморфни твърди вещества и проследени по време на втвърдяване и топене. Кристалните твърди вещества, имащи точка на топене - температурата е стабилен, когато съществува вещество в две фази - (. Крива 2 на Фиг) твърдо вещество и течност. Преместването на твърдо молекула в течна означава, че тя придобива още три степени на свобода на транслационно движение. по този начин единица маса на веществото с т.т.. в течна фаза има по-висока вътрешна енергия от едно и също тегло на твърдата фаза. Освен това, промяната на разстоянието между частиците. Като цяло, следователно, количеството топлина, необходимо за превръщане на единица маса на кристален материал в течността е:
където λ - специфичната топлина на топене (кристализация), (Uzh -Ukr) - разликата на вътрешната енергия на течността и кристални фази, P - външен натиск (VI -Vkr) - разликата на определени части. Според уравнение Clapeyron - температура Clausius топене зависи от налягането:

Очевидно е, че ако (VI -Vkr)> 0,
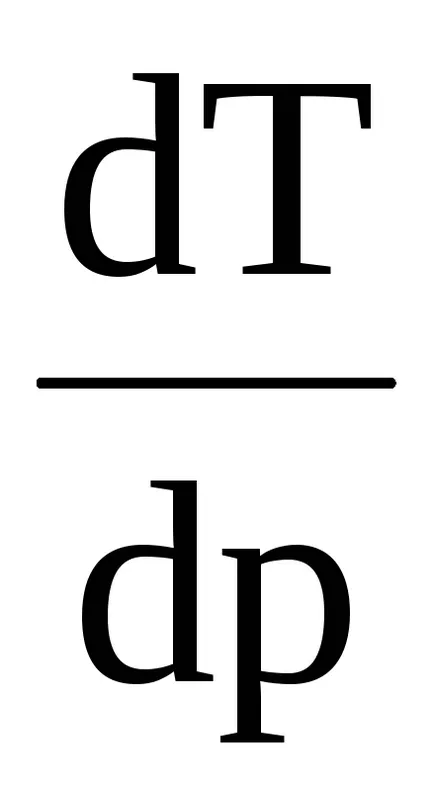
В аморфни твърди вещества топлина не. Нагряването предизвиква постепенно увеличаване на скоростта на термична движение и намаляване на вискозитета. Графиката има инфлексна точка на метода (фиг.), Който е конвенционално нарича точката на омекване.
Топлинните свойства на твърдите частици
Термично движение в кристали се дължи на силното взаимодействие на частиците се ограничава само вариации около местата на кристалната решетка. Амплитудата на тези трептения обикновено не се оказва 10 -11 m, т.е. Тя е само 5-7% от решетка период по съответните направления. Естеството на тези колебания е много трудно, както е определено от силите на взаимодействие между накланящата частица с всички свои съседи.
Увеличението на температура означава нарастването на частиците кинетична енергия. Това, от своя страна, означава увеличаване на амплитудата на движение на частиците и обяснява разширяване кристални твърди вещества чрез нагряване.
където LT il0 - линейни размери на тялото и в temperaturaht 0 0 0 ° С, а - вх-коефициенти на линейно разширение. За твърди вещества α е от порядъка на 10 -5 - 10 -6 K -1. В резултат на линейно разширение се увеличава и обемът на тялото:
тук β - коефициент на обемно разширение. β = 3α изотропен експанзия. Монокристални тяло е анизотропна, има три различни стойности на α.
Всяка частица колебае има три степени на свобода на вибрационното движение. Като се има предвид, че освен кинетичните частици също притежават потенциална енергия в една степен на свобода твърди частици трябва да се отдаде на енергията на ε = KT. Сега, за вътрешната енергия ще има мол:
и моларното топлинен капацитет:
Т.е. моларен топлина химически прости кристални твърди вещества идентични и независимо от температурата. Това е законът на Dulong-Petit.
Експериментите показаха, че този закон е доста добре изпълнени, като се започва от стайна температура. Обяснения отклонения от Dulong-Petit закон при ниски температури са били дадени от Айнщайн и Дебай специфична топлина в квантовата теория. Доказано е, че енергията, която е необходима за една степен на свобода не е постоянен, но зависи от честотата на температура и трептене.
Истинските кристали. Дефект Кристалите
Real кристали имат редица нарушения на идеалната структура, които се наричат кристални дефекти:
а) точка дефекти -
Шотки дефекти (частици незаети обекти);
Frenkel дефекти (изместване на частиците на възлите в междувъзлия);
примеси (чужди атома въведени);
б) линейни - ръб и винтови размествания. Този местен нередовен
STI в подреждането на частиците
поради незавършени отделни атомни равнини
или поради нередности в последователността на тяхното развитие;
в) съединителни - граници между кристали, редове от линейни размествания.