Адсорбция - спонтанни компоненти процес преразпределение система между повърхността
Адсорбция може да възникне в многокомпонентни системи и в преразпределението на повърхностния слой се компонент, който силно намалява повърхностното напрежение. В един компонент система, формирането на повърхностния слой на промяна в структурата си - за печат, който се нарича avtoadsorbtsiey.
Като цяло, адсорбцията може да се получи не само поради желанието за намаляване на енергията на повърхността, но и поради химична реакция с компонентите на повърхността на субстанцията. В този случай, повърхностната енергия може дори да се увеличи поради по-ниска енергия на цялата система.
Веществото, на чиято повърхност адсорбция настъпва се нарича адсорбента. вещество, което се преразпределя - адсорбат.
Обратният процес на преход на вещество от повърхността на обема на фаза - десорбция.
В зависимост от състоянието на фази агрегация се отличават газ адсорбция върху твърди адсорбенти, твърдо вещество - течност, течност - течност, течност - газ. две количества се използват за количествено определяне на адсорбция:
1) Специфичен адсорбция - размерът на адсорбата на единица повърхност на адсорбента:
,
където п - брой на моловете вещество в разтвора;
Б - повърхностна площ;
CB - адсорбат концентрация в повърхностния слой;
ч - дебелината на слоя.
2) стойност, определена от излишък на субстанция в повърхностния слой на повърхността на единица тегло или на адсорбента, наречен Gibbs адсорбцията или прекомерно (Т).
,
където CB, CV - адсорбат концентрация в повърхностния слой и в по-голямата част;

Представено равновесие система двуфазна това разпределени компонент се адсорбира в интерфейса. Границите на фазите в метода на "ограничен дебелина на слоя" :? А. Хв и кВ а. кВ б. Границите на повърхностния слой на кВ кВ б. Общият брой на моловете на разпределени компоненти:
. където 1 и 2- условията - броя молове на адсорбата в етапи без повърхностен слой; Трето - броя молове на адсорбата в повърхностна слой. Тогава общият брой на моловете адсорбат:
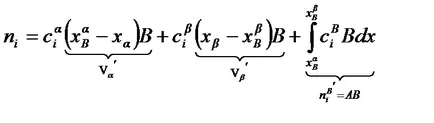
При използване на метода на излишните количества Гибс. където 1 и 2 условия - броя молове на адсорбата в фази, включително слой част повърхност с концентрации, равни концентрации в екрана; Трета термин - излишък брой молове от адсорбата попадащи върху повърхността на разделителната чиято абсциса кВ.
Представяне на излишък броя молове на адсорбата Ni B чрез средната концентрация в повърхностния слой (ако приемем, че постоянна през дебелината на повърхностния слой) след интеграция получаване. където Va и Vb Б Б - обемни части на повърхностния слой от фазата на съответно, и б.
За стойността на адсорбцията Гибс:
Ако адсорбат не преминава в обхвата на една от фазите (адсорбция върху твърди адсорбенти), уравнението става :. където V Б - количество на повърхностния слой; CI - концентрацията на адсорбат в по-голямата част.
За съотношения А и D образуват уравнението на равновесие по отношение на броя на моловете на адсорбата в повърхностния слой :. където Va и Vb Б Б - обемни части на повърхностния слой от фаза съответно, и б, CI V Б - брой молове от адсорбата в повърхностния слой без излишък.
Тук. където ч - дебелината на повърхностния слой.
Тези уравнения отразяват физическия смисъл на А и D, но те не могат да бъдат използвани за определяне на размера на адсорбция, тъй като неизвестен обем и дебелината на повърхностния слой.
За да се получи необходимия баланс уравнението съотношение състав за броя молове на адсорбата в цялата система преди и след адсорбция. където V и V V - общ обем на системата и количеството на фаза без повърхностен слой; С0 - начална концентрация на аз-ти компонент.
Премахването на броя на моловете на адсорбата в повърхностния слой. заместител инча получаваме:
Фигура количество А - цялата защрихованата област под кривата концентрация в профила на повърхностния слой, и стойност Т е квадратна с двойна щриховка.
При определяне на адсорбционната равновесие в количество адсорбира в повърхностния слой е зависим от концентрацията или парциалното налягане на този компонент в количество и температура. Според фаза правило Гибс ", броят на параметрите за определяне на състоянието на системата е равна (където F - степени на свобода, К - брой на компонентите на системата, F - брой фази 2 - два параметъра - налягане и температура).
В адсорбция на газова фаза система се състои от адсорбент и адсорбат газ Þ К = 2, р = 2, F = 2. Възможно е да се променят произволно два параметъра Р и Т за системата да достигне равновесие.
За кондензирано фаза (твърди и течни) K = 3 (адсорбирания разтворено вещество). Налягането в този случай се пренебрегва Þ F = 2: и с Т.
Т. Пр. всеки от параметрите на системата е еднозначно определена от най-малко две други параметри, т.е. , [3]
Видове адсорбцията в зависимост от параметрите на системата