6 фосфор, фосфиди
Фосфор, фосфиди. Фосфин. фосфорни оксиди (III) и (V). Орто-, мета- и пирофосфорна киселина. Ортофосфат. Естерите на фосфорната киселина
6.1. Фосфорен, фосфин, фосфат
Както азот, фосфор - с неметали, но nemetallichnost му не е толкова ясно изразен, по. Основните причини за тези различия, ние заключаваме, са по-големи в атомен радиус и в появата на г-орбитали на външния слой. Увеличаване на времето мярка атом води до отслабване на външното-връзка се електрон с ядрото. Това води до лесен-ти преход на електрони в възбудено състояние и прави химия елемент значително се различава от химията на азот. Той обикновено се появява като проява, присъщи на обикновените метали. За разлика от азот, фосфор не газ, но твърдо вещество кристална структура. Един от многото си модификации ало-тропичен - черен фосфор - полупроводник. Kis-lorodnye съединение е по-издръжлив и окислително-ционни функции в такива съединения, където е възможно окисление 5, напълно отсъства в оксиди, така и у киселини.
* Да бъдеш в природата
Най-богатите в апатит депозити света се намира в близост до град Кировск на Колския полуостров. Фосфорит доста разпространена, Нена в Урал, Поволжието, Сибир, Казахстан, Естония, Be-lorussii и др. Големи находища на фосфат са в Северна Африка, Сирия и САЩ.
Фосфор получава от апатит или фосфорит. Последно смесен с въглища (кокс) и пясък, се калцинира в електрон-параметър пещ при 1500 ° С
фосфорни пари, образувани се кондензират в приемника под вода.
Фосфор могат да съществуват в много модификации. В по-заслужава да има до 11 алотропна форма. "Много лица" на фосфор може, обаче, да се сведат до три основни типа: бяло, червено и черно.
Най-честата промяна е бял фосфор - безцветно восъчно и много токсично вещество с tplav = 44.1 ° С и точка на кипене 280 ° С В вода, тя е практически неразтворим, но водна пара е много лесно да се получи смес от газове. Той е разтворим в етер, бензен, терпентин и мастни масла, но най-добре във въглероден дисулфид. Запалва от триенето, така че това се нарязва на парчета само под вода. В тъмнината, LIT. Продължителен г загряване (250 ° С), бял фосфор става червена.
* Червен фосфор - прах от червено-кафяв цвят, това е абсолютно безвреден. По-малко активни от бял фосфор, неразтворим във вода и въглероден дисулфид, тя свети в тъмното. Той представлява смес от няколко алотропна модификации, които се различават по цвят (от пурпурно към червено) и някои други свойства.
^ Черно фосфор - най-стабилната форма на елемента. По външния си вид прилича метал: желязо има цвят оцветяване, има метален блясък има metalliches Coy електропроводимост, твърдост и топлопроводимост. В имената на активните твърди форми на фосфор. му
можете да го изрежете във въздуха, сякаш за да подпали един мач, черните фосфор светва с трудност.
Оказва бял фосфор продължително загряване при 200 ° С и налягане от 1200 МРа.
Имоти алотропна модификация на фосфор са обяснени по своята структура. Учи по-подробно структурата на бял фосфор. Той има молекулна решетка. Molek His-Ly chetyrehatomny (P4 - tetraphosphorus) и има правилна форма,-солна тристранен пирамидата.
Всяка фосфорен атом е в един от върховете на пирамидата и е свързано три PI-връзки с три други атоми. Червено и черно фосфор са полиатомен кристална решетка.
фосфорни атоми могат да се комбинират в Р2 молекули. Р4 и полимерни вещества.
Химическа фосфор активност значително по-висока от тази на азот.
Фосфор лесно се окислява с кислород: кислород над razuetsya фосфорен оксид (V), и недостига - фосфорен оксид (III):
В окислителната реакция се придружава от въздух излъчване него, т.е. Хемилуминесценция настъпва (излъчване на светлина в химични реакции).
Фосфор реагира с много проста вещество Е - халогени, сяра, и някои метали, и показващи окислителите и редукторите свойства. Съединения фос наречените хендикап метални фосфиди.
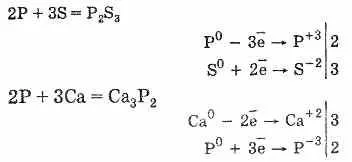
Фосфор осигурява съединения и преход група елементи с една и съща им V група: VP, VP2. ПНБ, NbP2. Тя кранове, TaP2.
Силни окислители фосфор превръща в фосфорна киселина:
Реакция на бял фосфор са по-добре от червено.
Фосфор при нормални условия не реагират с водород, така фосфорно съединение с водород - фосфин - се получават или чрез реакция с фосфорен основи:
Р4 3KON 3H2 О = PH3 3KN2 РО2 или фосфиди чрез взаимодействие с вода:
Фосфин PH3 - безцветен газ с мирис на "гнила риба". Това е токсичен, запалим във въздуха и може да образува експлозивни смеси, при определени състояние-вия. Фосфин-ЛИЗАЦИЯ при обикновени температури, не се разгражда, но при повишени температури и в отсъствие на кислород разпадане настъпва в значителна степен:
Слабо разтворим във вода: 1 обем фосфин разтваря в 4 обема вода. Известни много нестабилни кристални фос-Final PH3 • Н 2О, съответният състав хидроксид рН 4 ОН, -OD Нако основни свойства на това съединение не.
Фосфин соли подобни по структура на амониеви соли, внасянето във взаимодействието образуват силен разтвор на водородни киселини с газообразен фосфин. В сравнение с амониеви соли са по-малко стабилни.
РН 4 SlO4 фосфониев перхлорат експлозив, халогениди и напълно се разлага при нагряване: PH3 = Cl рН 4 със солна киселина
В определени съотношения на кислород и рН 3 сместа autoignites:
Фосфин - един от най-силните редуктори. Той регенерира navlivaet метални соли в разтвор на фосфиди а в някои случаи до метали:
Тъй като фосфорни халогениди фосфин реагира на неговото освобождаване средната свободен фосфор:
Червен фосфор се използва в индустрията мач. Червен фосфор, антимон сулфид (III), червен железен оксид (природен оксид на желязо (III) с добавка на кварц) и лепило педант подготвят от смес, която се прилага към страничните повърхности на кутията на спин-верижен. Централен преса се състои главно от калиев хлорид-пропорционално, матово стъкло и лепило. Чрез триене на главата се разпространява кибритени червен фосфор се запали, запалва част на главата, както и от светлините му дърво.
Белият фосфор имат широко приложение. Обикновено се използва за производство на дим екрани. Черно фосфор при смяна много рядко.
^ 6.2. фосфорни оксиди (III) и (V)
Фосфор образува редица оксиди, от които най-проучен и важно от практическа гледна точка, фосфорен оксид (III) Р2 О3 и фосфорен оксид (V) Р 2О 5.
фосфорни оксиди (III) и (V) имат една обща характеристика. При определяне на истинската им формула се оказа, че те са дори по двойки са димери. Техните формули трябва да бъдат написани, както следва: P4 и P4 Ø10 О6. Причината за възникване на такава необичайна структура образуване температура някои изследователи стремят виж-SRI фосфор поддържа P4 молекула структура и по-нататък да образуват тетраедър, в центъра на който е разположен на фосфорния атом и атомите на кислорода в ъглите. Този тип структура се различава etsya висока якост и се съхранява в допълнително стабилни О-киселини на фосфор и фосфати.
^ Фосфорен оксид (III) Р2 3 (P4 О6) - Ceska восъчно кристална маса с т.т. 23,8 ° С, лесно разтворим в органични разтворители въп. Силно токсичен. Получават се чрез изгаряне на фосфор при условия на ограничено кислород:
Чрез химични свойства Р2 О3 е кисела хидрокси-къща чрез взаимодействие с вода при стайна температура форми фосфориста киселина:
Но достатъчно малък, за топлинна енергия за вместо хидрат-ТА е редокс процес:
Реакцията с форми на алкална сол: 4NaOH Р2 О3 = 2Na2 HPO3 Н 2О
фосфорен оксид (III) притежава регенеративни свойства Mi: окислява с кислород на Р 2О 5. Р2 О3 O2 = Р 2О 5
^ Фосфорен оксид (V) Р 2О 5 (P4 Ø10) - хигро-бял ронлив skopichny прах в насипно състояние до пухкав. Получава се от първа рений фосфор в излишък на въздух или кислород:
Много реагира енергично с вода за образуване на фосфор-маслена киселина:
Тази функция на Р 2О 5 ви позволява да го използвате, широко използван като ефективен дехидратиращо средство.
Той е в състояние да конвертира сярна киселина и азотен оксид от:
С основни оксиди реагира само с синтез:
Реагира с основи:
^ 6.3. Орто-, мета- и пирофосфорна киселина. ортофосфат
фосфорен оксид (V) Р 2О 5. взаимодейства с вода, форми NRO3 метафосфорна киселина; последните се образува по време на кипене
^ Таблица 23. фосфорна киселина
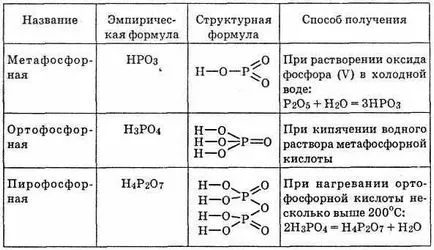
ортофосфорна киселина Н 3РО 4; чрез нагряване на Н 3РО 4 образува дифосфорен (или пирофосфорна) киселина Н4 Р2 О7 (вж. таблица. 23).
Метафосфорна киселина, и е нестабилен в чист вид не е ви-допринесъл както и решения не са изолирани от негова сол. Може да съществува като полимер (NRO3) п. Освен това е възможно мак-макромолекули, като се започне от степента на полимеризация п = 3. metaphos-Forney киселина е много силен, всички водородни йони в него дисоциация-ти напр. Въпреки това, те не са специфични за всяко окисление или редукция на качеството. Вода макромолекула метафосфорна киселина разцепва на Н 3РО 4.
По този начин, метафосфорна киселини са нестабилни и предварително негодува на само междинен етап реакцията ЛИЗАЦИЯ хидрат фосфорен оксид (V) Р 2О 5.
^ Фосфорна киселина Н 3РО 4 - най-стабилните на всички киселината на петвалентен фосфор. Това е безцветно кристално твърдо вещество топим вещество. Нейната кристално Ли се превърне в сироповидна маса във въздуха. Нетоксични-та. Тъй като водата се смесва във всякакви пропорции. При нормални температури, инертен, не се възстанови въглища и дори vodoro къща. Той не показва окисляващи или редуциращи свойства. Но когато нагрява реагира с метали и техните оксиди, действа върху кварц и дори злато.
Тъй като има якост средно киселина. Упражнява своето коте lotnye свойства при взаимодействие с основи:
В промишлеността, ортофосфорна киселина се получава по два метода: екстракция и термично. При първия метод раздробен калциев фосфат се обработва със сярна киселина:
CaSO4 утаява като утайка и киселината остава в разтвор. Така в разтвора на киселина движи много примеси - сулфати на желязо, алуминий. Тази киселина е производство на торове.
При втория метод, първо, фосфор (RECOV-niem естествени фосфати). След това той се окислява до P4 Ø10. и поз-Lednev взаимодейства с вода. Получен е чиста киселина (концентрация 80%).
Молекулата на ортофосфорна киселина с водородни атоми, свързани с кислороден-HN атома:
Във воден разтвор, ортофосфорна киселина се подлага на дисоциация Стю-типично стъпка отговор:
Етап III: N HPO 4 2- PO 4 3-
Аз обикновено доминира етапа на дисоциация. В качеството си на триосновно, той образува сол - ортофосфат три вида:
1) фосфат - заместени всички водородни атоми на фосфорна киселина (K3 РО4 (NH4). 3 РО4);
2) хидрогенфосфати - заместен с два киселинни водородни атоми (NRO4 K2 (NH4.) 2 НРО 4);
3) дихидрогенфосфат - заместен един водороден атом на киселината (КН 2РО 4 NH4 Н2 РО4) ..
Всички фосфати на алкални метали и амониеви са водоразтворими. Тъй като калциеви соли на фосфорна киселина, разтворена във вода само Са (Н2 РО4) 2 - дихидроген фосфат. Калциев хидроген фосфат CaHPO 4 и калциев фосфат, Са 3 (РО 4) 2 са разтворими в органични киселини.
Соли на ортофосфорна киселина са ценен тор.
Суперфосфат - смес от CaSO4, и Са (Н2 РО4) 2 • Н2 О. За получаване на депозитите на природен фосфорит суперфосфат обработва със сярна киселина:
^ Суперфосфат Dual Са (Н2 РО4) 2 се получава чрез действието на киселина фос-Forney естествен калциев фосфат:
CaHPO на утайка 4 • 2Н2 О е неразтворим във вода, но е разтворим в киселина etsya почви. Net използване утайка в качеството Island fosfornoizvestkovoy добавка към фуражите говеда. Получава се от калциев хидроксид:
Ammofos - смес от NH4 Н2 PO4 и (NH4) 2 НРО 4 - ценен тор-комплект, съдържащ азот и фосфор. Получава се чрез взаимодействие ч Miaka с фосфорна киселина.
натриев дихидроген фосфат NaH2 РО4 използва в медицината.
^ Пирофосфорна киселина Н4 Р2 О7 е мека стъкловидна маса (т.т. = 61 ° С), лесно разтворим във вода. Kis--основен много и е по-силна от фосфорна.
^ 6.4. Естерите на фосфорната киселина
В литературата са описани голям брой про-органични производни на фосфорна киселина. Това Естери техните мол-kuls състоят от радикал и анион на органична алкохол фосфор киселина. Някои от тях са изключително важни за организма. Например, фосфати на захари:
или производни на глицерол и фосфорна киселина:
Фосфорни естери на захари играят важна роля в фотосинтетичния-SE и метаболизъм и глицерофосфорна киселини участват в превръщането на мазнини.
Съединения, състоящи се от остатъци на двете киселини и взаимодействие действащ с образуване на киселина на вода, посочени sme-
shannym анхидрид. съществува такава анхидрид на оцетната и фосфорна киселини:
Общувайте лесно се разграждат между тях. Подобен процес се среща в природата в синтеза на протеини.
Двата най-важни за жив организъм киселина - ДНК (дезоксирибонуклеинова) и РНК (рибонуклеинова) - предварително негодува дълга верига, усукана спирално и съвместно състояние на променлив въглехидрати и фосфатни групи. Хидролизата на тези киселини се разлагат в отделни въглехидрати фосфатни вериги.
Друг важен вид биологично важно Кон-neny са fosforproteidy. Представител на този тип сътрудничество единство - казеин е основната част от извара и сирене.
Значение органофосфорни молекули за земни форми на живот изключително. Въз основа на тях, цялата работа, необходими на май "биологични машини" на тялото. Тайната се крие etsya високо енергийно съдържание на фосфат P-O облигации. Koh да в adenosinetriphosphate разцепва под действието на вода молекула на Н 3РО 4. стои около 50 000 кДж (за 1 мол). ОТДЕЛЕНИЕ молекула на Н 3РО 4. ЕДНА прибавянето на молекула на органо-вещество-етнически, Prien сито с енергийно богати връзка. Такава структура е по-лесно да влезе органофосфорно част хи-номически трансформация - тя е по-голяма активност. По този начин, енергията-бо-gatye комуникация може да се превърне-schatsya от една молекула на друг, и доставка на енергия за всички клетки на тялото (вж. Фиг. 21).
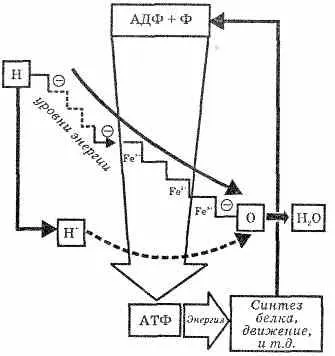
Фигура 21. Схема превръщане аденозин-три-фосфорна (АТР) и аденозин дифосфат (ADP) киселини в организма.