1F · 1023 · 1
1F = 96500 = CI и 26.8 часа ·
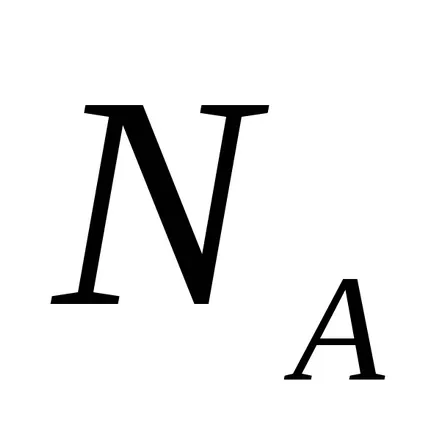

Ако разтворът преминава през Фарадей електроенергия 1 (Cl 96500), електрод ще застане на 1 мол еквивалент вещество.
2. Вторият закон на Фарадей:
Съгласно закона втори Фарадей, при определено количество ток преминава масово съотношение, равно на съотношението на нереагиралите вещества, техните химични еквиваленти.
Химически еквивалент член е съотношението на масата на елемент, който се свързва или замества в химични съединения на атомно тегло от водород или кислород атомната маса половина до 1/12 масата на С12 атом.
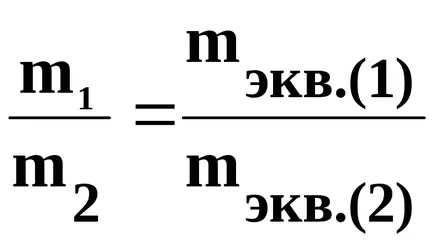
където m1 - маса на материала (1), оформен или подлага на превръщане вещество: mekv1. - неговата еквивалентно тегло; - (2), оформена маса от материал m2. mekv2. - неговата еквивалентно тегло;
3. комбинирани закона на Фарадей:
Тегло на електролит, непревърнати време на електролиза и тегло вещества оформени на електродите е пряко пропорционална на количеството електричество преминава през електролита и еквивалентни тегла на веществата.
Този закон се изразява чрез следното уравнение:

където m - получената маса, или се подлага на превръщане вещество: mekv. - неговата еквивалентно тегло; I - тока, т - времето в секунди, F = 96500 CL - Фарадей номер (или т - времето в часове, след това F = 26,8 А); BT - ток.
Или при изчисляване на обеми освободен газове:
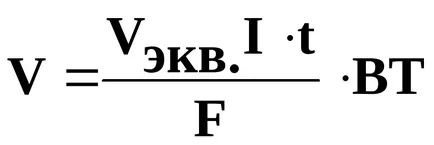
V - обем на отделеният газ (L); Vekv. - еквивалентен обем (л / мол). Тъй като при нормални условия на еквивалентно количество водород е 11,2 л / мол, и кислород - 5,6 л / мол.
Добив вещество ток
В електролиза, може да тече повече паралелни реакции - основните и страна да се даде възможност за влиянието на странични реакции, понятието е въведено от "ток ефективност". Сегашната ефективност - съотношението на теоретично, необходими за получаването на дадено количество електроенергия (в съответствие със закона на Фарадей) до почти количеството електроенергия, изразходвана. За да се намали консумацията на електроенергия за електрохимични странични реакции и увеличаване на тока са склонни да се провежда електролиза при такива условия, при които разлагането на разтворителя е трудно, т.е. високо поляризация време окисление или редукция на разтворителя (например кислород пренапрежение или водород). Това се постига чрез увеличаване на плътността на тока, промяната на температурата на електролита, изборът на електролит материал и други подобни. D.
Настоящото ефективността стойности на част от количеството електроенергия предава, което попада в тази реакция електрод:
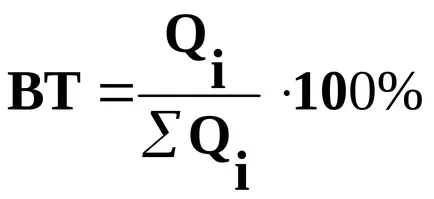
където

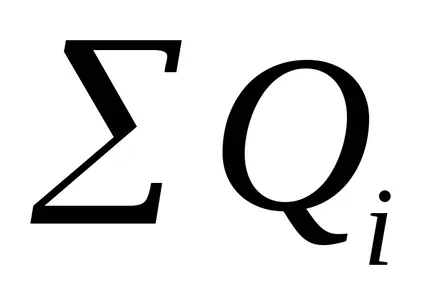
Настоящата ефективност може да бъде определена като съотношението на получения продукт на електрохимически реакции (

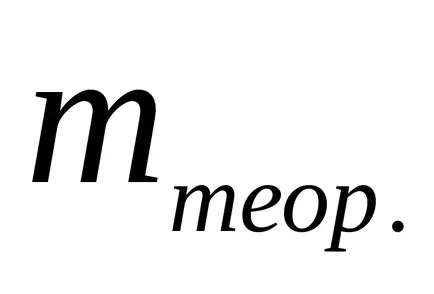
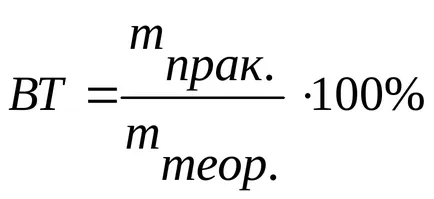
Има системи, в които всички количеството предадена мощност се консумират само на една реакция електрод, след VT = 1 или 100%. Такива електрохимични системи, използвани за измерване на мина и по-нататък "coulometry" електроенергия.