Определяне на молекулно тегло nonelectrolyte cryoscopic метод
Разтворът се нарича система еднофазен, образуван от поне два компонента и може до известна степен да непрекъснатата промяна в състава. Въпреки това, някои свойства на разтвора се сменят, промяната не зависи от естеството на разтвореното вещество и концентрацията на разтворената, независимо от неговата химична структура. Това показва, че разтвореното вещество не реагира с разтворителя. Такива свойства се наричат colligative разтвор (думата "Collegiate" ( "collig" - колеги) означава "свързани един с друг"), в зависимост от броя на разтворените частици. Те включват:
· Намаляване на налягането на парите на наситена пара горе разтвора;
· Повишаване на температурата на кипене на разтвора - ebullioscope;
· Намаляване на точката на замръзване на разтвора - криоскопия;
Основните от тях е понижаване на налягането на парите, и другите три свойства са получени от него като следствие.
Тъй colligative свойства зависят от броя на разтворените частици, той позволява да се определи с тях молна маса вещества, най-точно от които е cryoscopic метод. Cryoscopic метод се нарича метод за определяне на моларната маса на веществото за понижаване на температурата на замръзване, беше разреден разтвор по отношение на чистия разтворител.
Cryoscopic метод се използва за определяне на редица физични и химични константи на разтвореното вещество, както и за изследване на свойствата на разтвори и биологични течности (кръв, стомашен сок, гръбначномозъчна течност, урина, и т.н.).
За разтвори на не-електролити cryoscopic метод може да се определи моларна маса на разтвореното вещество, за електролитни разтвори и биологични течности - осмоларност и осмотичност за разредени разтвори на електролити - степента на дисоциация, и следователно дисоциационната константа на разтвореното вещество.
Физико-химични изследвания са показали, че депресията (точка на замръзване депресия) се характеризира със значителна човешка кръв постоянството: границите на нормалните колебания в стойностите на депресия е 0,55-0,58 °. Големината на депресия 0,59 ° точки вече на отклонение от нормата, и 0.60 на патологията. Устойчиво стойност кръвта на депресия показва постоянството на своя осмоларитет. Разлика между венозна и артериална депресия на 0,01-0,02 ° кръв и зависи от степента на обогатяване на венозна кръв въглероден диоксид и други метаболитни продукти.
Ненормално високи стойности на циркулация на депресия наблюдава при заболявания на сърцето, белите дробове, бъбреците заболявания и в случай на нарушение на нервната система кръв. Необичайно ниска депресия може да бъде по време на бременност и тежка интоксикация.
Показания депресия урината варира в широк диапазон от 0,1 до 3,5 °.
Точност и лекота на cryoscopic метод даде възможност да го използва в клиничната практика.
Съгласно закона Раулт на парата разтворител горе Р1 разтвор при всяка температура Т е равно на парното налягане на чистия разтворител Р1 °, умножена по молната фракция на разтворител в разтвора, т.е.
Това предполага редица важни последици:
1 следствие - krisoskopichesky основания: температурата на замръзване на твърдия разтвор е винаги под точката на замръзване на чистия разтворител, при условие, че замразяването се съпровожда от отделяне на чист разтвор твърд разтворител (виж фигура 1 ..):
където Dtzam. и # 916; Tzam - промяна при понижаване на точката на замръзване на разтвора в сравнение с разтворител, изразена в градуси по Целзий и Келвин, съответно.
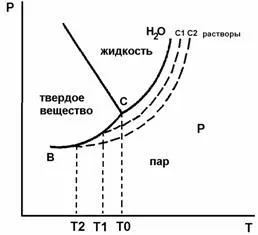
Фиг.1. Диаграмата фаза на вода и разтвори с концентрации на С1 и С2 (криоскопия), T0. T1. Т2 - минусови температури
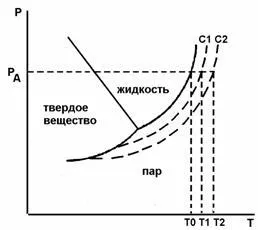
Фиг.2. състояние диаграма и воден разтвор с концентрация на С1 и С2 (ebulliskopiya) T0. T1. Т2 - точката на кипене
В по-концентриран разтвор, толкова по-голям спад в налягането на парите по-горе разтвор, толкова по-голяма трябва да бъде # 916; Tzam. следователно
където К - cryoscopic константа Cm - концентриране на разтвора в мол / 1 кг разтворител (molal концентрация).
Pure разтворител и разтворът поради появата на кристализация трудности са склонни да SuperCool, които могат да бъдат 1-2 ° С в сравнение с истинския tzam. При енергично разбъркване, преохлажда течност започва да кристализира разтворителя и температурата се повишава с излъчване на топлина от кристализация. Максималните температури наблюдавани при кристализацията на чист разтворител и разтворител на разтвора се приемат като точката на замръзване на чистия разтворител и разтворът, съответно.
коефициент к за всеки разтворител е постоянна стойност, наречена моларен понижаване точката на замръзване или cryoscopic константа. Числовата стойност на К е # 916; tzam. , където Cm е равно на 1 мол на 1 кг разтворител (odnomolyalny разтвор).
Следствие 2 - ebullioskopichesky основания: температура твърд разтвор е винаги кипене над точката на кипене на чистия разтворител при същото налягане.
Ebullioskopiya - увеличаване на точката на кипене на разтвора, в сравнение с чистия разтворител (виж фигура 2 ..):
където Cm -. концентриране на разтвора в мол / 1000 грам разтворител (molal концентрация), Е - ebulioskopicheskaya постоянна. Ebullioskopicheskaya константа равна на промяната odnomolyalnogo точката на кипене на разтвора в сравнение с разтворител.
3 sledstvie.Osmos - едностранно преход феномен на молекули на разтворител в разтвор чрез пореста полу-пропускащата мембрана (мембрана) в по-висока концентрация на разтвореното вещество. Тя се нарича на осмотичното налягане на най-ниското налягане да се прилага към разтвор за предотвратяване на потока от разтворител през мембраната в разтвора с по-висока концентрация на веществото.
Молекули на разтворителя като молекула, съгласно всяка от задвижван сила срещащи се дължи на разликата на химичните потенциали. Когато вещество се разтваря, химичното потенциала на разтворителя се намалява. Следователно, в областта, където концентрацията на разтвореното вещество над химически потенциала на разтворителя под. По този начин, молекулите на разтворители, които се движат от разтвора на разтвор с висока концентрация, се движат в термодинамичен смисъл, "надолу", "на градиента".
В разтвори, които съдържат смес от електролити, като разтвори, включват всички биологичната течност, изчисляването на броя на независими частици кинетично възпрепятствано. В тази връзка, лекарството се използва понятия като осмотичното налягане и осмоларитет.
Съгласно osomlyarnostyu (и осмотичност) означава концентрацията на активни частици, не прониква през полупропусклива мембрана идеален. измервания единици осмоларността съвпадат с моларната концентрация на блоковете и осмотичността - molal концентрация. За разредени разтвори може да се приеме, че числовите стойности на осмотичното налягане и осмоларност на същото. В действителност, осмоларитет и осмоларитет се дефинира математически като, съответно, са опитни данни, използването на която дава възможност да се вземат предвид различния характер на отклонението от закона Раулт възникващи в случай на неспазване на идеални решения.
Осмотичното налягане на кръвта зависи от плазмената концентрация на разтворени вещества (молекулни електролити и не-електролити) и представлява количеството на осмотичното налягане съставка, съдържаща се в него. Осмотичното налягане на кръвта. произведени кръв протеин, наречен онкотично налягане. По този начин повече от 60% на осмотичното налягане на натриев хлорид се генерира, и само част от неорганични електролити пада до 96% от общата осмотичното налягане. Осмотичното налягане е един от твърда хомеостатична константа и е здрав човек средно 7.6 атм с възможен обхват на трептения 7.3-8.0 атм. Ако вътрешната среда на течен или изкуствено приготвен разтвор има същото осмотично налягане като кръвта на нормална плазма, подобен на течната среда или разтвор наречен изотоничен. Съответно, течност с високо осмотично налягане, се нарича есенциална хипертония. и по-ниско - хипотоничен.
В осмотичното налягане може да се изчисли с помощта на закона за Van't Hoff:
където SM - концентриране на разтвора в разтвор мола / L (моларна концентрация), R - е универсална константа на газа. Т - е температура, К.
Всички зависимости обсъдени по-горе са приложими само за разредени разтвори на неметалните електролити.
Цел: да се определи молекулното тегло на глюкоза метод точката на замръзване депресия.
Изходното устройство за измерване на потискането на замръзване
Ø Везни лабораторни
Ø 150 милилитрова бехерова чаша (или колба)
Ø термометър мащаб интервал 0,1 ° C
Ø охлаждане на сместа (лед и сол)
Ø Дестилирана вода
Основната част от инструмента - цилиндъра (или тръба), което горен отвор е затворен плътно затворен. Тръбата се засилва термометър за измерване на температурата на флуида поставя в цилиндъра. Също така преминава през тапа от тънка тел бъркалка. В долния край на бъркалката е огъната като пръстен свободно, покриваща долната част на термометъра.
Цилиндърът се поставя в бехерова чаша от дебел стена с капак напълнена с охлаждаща смес. Студената смес се разбърква с бъркалка, направен от дебел проводник.
За да се получи по-точни резултати по време на измерване на цилиндър се препоръчва да не директно поставя в охлаждаща смес, и в по-широк цилиндър. Така между охлаждане сместа и бутилката с разтвор на въздушна възглавница риза тест е създаден, което осигурява по-равномерно охлаждане.
Опитът №1. Измерване на температурата на замръзване на разтворителя
1. Изготвяне на охлаждане смес от лед и сол. Температурата на сместа от хладилен агент трябва да варира от -7 до -5 ° С Ако е необходимо, се коригира чрез добавяне на няколко кубчета лед, ако температурата е под 7 ° С, или смес от поръсване сол при температура над -5 ° С Напълнете охлаждащата течност смес от стъкло.
2. Цилиндърът се излива в 70 мл дестилирана вода. Поставя се в охлаждаща смес, запушалка с бъркалка, термометър, монтиран в него. Нивото на водата в бутилката трябва да бъде 0,5-1 см над нивото на резервоара на живак, резервоар живак трябва да са разположени в миксер пръстен.
3. Водата се разбърква енергично в цилиндъра за да се избегне отлагане на лед върху стените на цилиндъра.
Обикновено, при постепенно охлаждане вода остава течност при температура малко под нула градуса. След това, при достигане на определена температура на кристализация започва рязко през цялото време. Температурата се повишава рязко до 0 ° С и остава постоянна по време на кристализацията.
При непрекъснато разбъркване, наблюдение на намаляването на живака в капиляра. При определена температура в преохладени вода ледени кристали започват да се появяват. Меркурий се издига бързо и спира. В рамките на тридесет секунди гледане на позицията на менискуса и менискус позиция фиксирана броене температурата на продукция.
4. След отстраняване цилиндъра от охлаждане сместа се загрява ръка. В този случай ледените кристали се топят. Размразяване с разбъркването продължава докато живакът се издига до горната капилярна коляното.
5. Поставете чашата отново до охлаждане и сместа беше решена термометър четене, съответстваща на температурата на замръзване. Общо произведени три такива определения. Резултатът трябва да бъде средната аритметична стойност от три определяния.
Опит № 2. Определяне на точката на замръзване на разтвора
1. В сух стъкло 150 мл вземе проба от около 3.5 грама глюкоза, до 0,01гр пипета 100 мл вода, разбърква се до пълно разтваряне пръчка глюкоза.
2. Цилиндърът се промива с малка порция от разтвора. След това се излива в 70 мл разтвор.
3. Извършва температурата на замръзване, както е описано по-горе. Резултатът трябва да бъде средната аритметична стойност от три паралелни определяния.
4. определянето се повтаря, като пробата на 2.5 грама глюкоза и 1,5 гр
Както е измерено чрез изчислена молекулна маса на глюкоза.
1. хоросан (определение, методи експресионни концентрация разтвор). Каква е разтворител, разтвореното вещество?
2. Какво е "идеален" решение?
3. Какво се нарича наситена пара?
4. Правото на Раул. Отклонение от Право на Раулт.
5. Последици на правото Раулт.
6. Какво е точката на кипене, точката на замръзване?
7. Обяснете причините за това явление и cryoscopic ебулиоскопия. Когато отговор използването ориз. 1-2.
8. Извадете формула за изчисляване Tzam т.к. и разредени разтвори на неметалните електролити и електролити.
9. cryoscopic ebullioskopichesky и методи за определяне вещества молекулно тегло.
10. cryoscopic и ebullioskopicheskaya постоянна. Как могат да бъдат изчислени и как да се определи експериментално?
11. Как да изберем разтворител за cryoscopic и ebullioskopii?
12. Какво е осмоза?
13. Van't Hoff уравнение за изчисляване на осмотични разтвори налягане на неметалните електролити.
14. Colligative свойства на електролитни разтвори.
15. Изотонични коефициент. Как мога да се определи сумата на физиологичен фактор, това, което зависи от?
16. Понятието изотонични, хипертонични и хипотонични решения.
17. Изчислява точката на кипене и точка на замръзване от воден разтвор на фруктоза с масова фракция 4%.
18. Изчислете моларна маса nonelectrolyte, ако е известно, че понижаването на температурата на замръзване на разтвор, съдържащ 5 г от този материал в 500 г вода, равно на 0.102 К.
19. Това, което трябва да бъде теглото на захароза се разтваря в 250 г вода, за да се получи разтвор, кипяща при 100,2 ° С? На каква температура да замрази решението?
20. Изчисли тегло на урея, които могат да бъдат разтворени във вода в колба капацитет 200 мл за да се получи разтвор, изотоничен разтвор, съдържащ 4,28 грама захароза тегло в разтвор от 100 мл.
21. осмотичното налягане на концентрата на кафе при 10 ° С е 2,37 МРа. Изчислява осмоларността на разтвора.
22. описва поведение на електролити при 310 К в разтвор на глюкоза с масова фракция 2% (г / мл плътност 1.006 разтвор).
23. Изчисли на осмотичното налягане при 310 К от 10% воден разтвор на манитол с плътност от 1,04 грама / мл, който се използва за понижаване на интракраниалното налягане. Как този разтвор (хипо-, хипер- или изотоничен) по отношение на разтворите A-D има следните стойности на осмотичност: а) 780 кРа (кръв, горна граница); б) 730 кРа (кръв, долна граница); в) 258 кРа; ж) е 3,091 кРа; д) 1472 кРа?