натриев хипохлорит
Структурната формула на натриев хипохлорит с маркирана върху й зареждане атома
На натриев хипохлорит. натриева сол на хипохлориста киселина е химично вещество с химична формула NaOCl, използван като белина и дезинфектант, водни разтвори на вещества, използвани в стоматологията като иригационен.
физични свойства
- Има три известни кристален хидрат на съединението: монохидрат, NaOCl * 2.5 Н2 и топотекан NaOCl * 5 Н2 О.
- Свободното форма е бяло кристално вещество, много нестабилна.
- По-стабилни под формата на NaOCl * 2.5 Н2 О, е относително стабилен под формата на пентахидрат NaOCl * 5 Н2 О или водни разтвори.
- Силен окислител като корозионни свойства.
- Плътност - 1,11 гр / см 3; 1.574 грама / cm 3 (топотекан); 1.04 гр / cm 3 (плътност на популярен дентална 5-6% воден разтвор при стайна температура).
- Точка на топене: в свободния натриев хипохлорит настъпва фазов преход; NaOCl * 2,5 Н 2О - 57.5 ° С; NaOCl * 5 Н 2О - 24,4 ° С
- Точката на замръзване на водните разтвори: 0.8% - -1 ° С; 2% - -2.2 ° С; 4% - -4.4 ° С; 6% - -7.5 С.
- Разтворимост във вода - 53,4 грама / 100 мл (при 20 ° С температура), 130 г / 100 мл (при 50 ° С температура).
химични свойства
Натриев хипохлорит е нестабилно съединение и лесно се разгражда от следните реакции:
При нагряване се случва паралелно и диспропорциониране реакция:
3 NaOCl = NaClO3 + 2 NaCl
Хидролизата и разпадане във водни разтвори
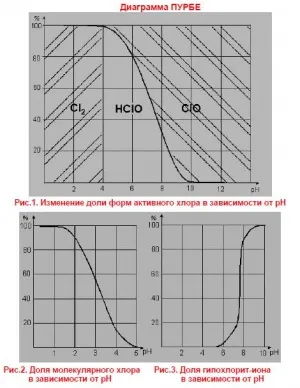
Промяната във формата на активен хлор натриев хипохлорит разтвор при различни рН
натриев хипохлорит във водни форми хипохлориста киселина и хипохлоритен йон в пропорции, определени от рН на разтвора. Съотношението между хипохлоритен йон и хипохлориста киселина се определя от появата на реакцията на хидролиза на натриев хипохлорит и хипохлориста киселина дисоциация (фиг. Промяната във формата на активен хлор разтвор на натриев хипохлорит, в зависимост от рН на разтвора).
Водни разтвори на натриев хипохлорит дисоциира в натриев йон и хипохлоритен йон:
Хипохлоритен йон във водна среда се хидролизира:
Водни разтвори на натриев хипохлорит е нестабилен и се разлагат по време дори при нормална температура (0.085% на ден). Decay ускоряване осветление, йони на тежки метали и хлориди на алкални метали; В контраст, магнезиев сулфат, ортоборната киселина, силикати и натриев хидроксид бавен процес; където най-стабилни разтвори с висока алкална среда (рН> 11).
В силно алкална среда (рН> 10), когато хидролизата се потиска хипохлоритен йон, разлагането се провежда както следва:
При температури над 35 ° С, последвано от реакция на разпадане диспропорциониране:
В среда с индикатор за рН 5-10, когато концентрацията на хипохлориста киселина в разтвора е значително по-висока разлагане е както следва:
HOCl + 2 СЮ - = ClO3 - + 2 Cl - + Н + HOCl + СЮ - = O2 + 2 Cl - + Н +
По-нататъшно намаляване на рН, когато вече не е в разтвор СЮ - йони чрез разлагане е както следва:
3 HClO = ClO3 - + 2 Cl - + 3 Н 2 HClO = O2 + 2 Cl - + 2 + Н
Накрая, когато рН е под 3, разлагането е съпроводено от освобождаване на молекулно хлор:
Vyshenapisannomu Като обобщение може да се каже, че при рН над 10 кислород разпадане настъпва при рН 5-10 - кислород и хлорат при рН 5.3 - хлор и хлорат при рН по-малко от 3 - разлагане на хлорен натриев хипохлорит.
Кисело хипохлорит разтвор на натриев на солна киселина, хлор могат да се получат:
Натриев хипохлорит е силен oksidatorom взаимодействие с много редуциращи средства, независимо от рН.
биологични свойства
Натриев хипохлорит има маркиран антимикробна активност се дължи на хипохлоритен йон. Антимикробни свойства на натриев хипохлорит вече проявяват при много ниски концентрации, които не са ясно изразен влияние organoliticheskim. Висока бактерицидна мощност на натриев хипохлорит е показано в разтвори с рН близо до неутрално, когато концентрацията на хипохлориста киселина и CLO - йони е приблизително равна.
Използването в стоматологията
0.5-5% воден разтвор на натриев хипохлорит в стоматологията се използва като базов материал за изплакване канали с ендодонтични процедури. Това място позволява веществото да вземе своя разрушителен ефект върху тъканта на пулпата. на био-органично вещество и антимикробен ефект.
Dental Химически вещества
воден разтвор на натриев хипохлорит разтвор има динамичен процес, който може да бъде описан в съответствие с уравнението:
NaOCl + Н 2О ← → NaOH + HOCl ← → Na + + OH - + Н + + OCl -
РН алкален воден разтвор на натриев хипохлорит обясни образувана по време на реакцията на натриев хидроксид, което се дисоциира силен от дисоциира образувани хипохлориста киселина.
Реакция с вещества bioogranicheskimi
Както в случая на жизнено маса, и в случай на пулп некроза в канал има голям брой на био-органични вещества, такива като протеини, мазнини, въглехидрати, нуклеинови киселини.
Реакция с мазнини
Взаимодействие с мастни киселини, натриев хипохлорит (или по-скоро, в хода на реакцията образува дуплекс натриев хидроксид) ги превръща в натриеви соли на мастни киселини (сапуни) и глицерин. Като сапуни и глицерол понижи напрежението на останалия разтвор, което улеснява проникването на материята в тясна част на канала повърхност. Хипохлористата киселина реагира само в местата на ненаситени връзки, където се добавя един от въглеродните атоми на хлор, а на друг - хидроксилна група, в която са оформени хлорхидрини.
Реакция с протеини
По време на реакцията между натриев хипохлорит и аминокиселини, натриев хидроксид неутрализира амино киселина за образуване на натриева сол на амино киселина, с вода и chlorinates хипохлориста киселина аминокиселина, като хлорамини. Хипохлористата киселина реагира с аминокиселини със странични амино, амино, заместен с водород в хлора. Хлорирани аминокиселини разграждат бързо, ако те не са в протеините в протеини, съдържащи хлорирани аминокиселини са много по-трайни. Въпреки това, намаляването на броя на аминогрупи в протеина поради тяхната хлориране увеличава скоростта на разграждане в последната аминокиселина.
Освен това беше установено, че хипохлориста киселина е ефективен инхибитор на сулфхидрилни групи, и в достатъчно количество, за да може да се инактивира напълно протеини, съдържащи аминокиселини с тези групи. Oksidiruya сулфхидрилни групи, хипохлориста киселина предотвратява образуването на дисулфидни мостове, които са отговорни за омрежване на протеини. Установено е, че на хипохлориста киселина може да се окисли 4 пъти амино група към сулфхидрилна: 3 пъти реагират с -SH група до получаване на R-SOH, R-SO2 Н и R-SO3 Н производни, и четвърто време - с амино група в позиция алфа. Всяка от първата от трите междинни съединения може да бъде кондензиран с друг сулфхидрилна група и причина адхезионни протеини.
Реакция с нуклеинови киселини,
Хипохлористата киселина реагира с двете ДНК и РНК, и с отделни нуклеотиди. Реакция с хетероциклични групи NH-бързо от реакцията с амино група на хетероцикъла, следователно не е бързият реакция настъпва с тези нуклеотиди, които имат хетероциклична група NH - гуанозин и тимидин монофосфат. uridinmonofosfata реакция, която въпреки че е хетероциклена NH група, но е много бавен. Аденозин и tsitizinmonofosfat като не хетероцикличен NH група реагира странични -NH2 групи достатъчно бавно.
Тази реакция с натриев хипохлорит (хипохлориста киселина) нуклеотиди в nukleokislotah предотвратява образуването на водородни връзки между полинуклеотидни вериги.
Реакцията с рамката на въглехидрати не се случи, външна подкрепа остава непокътнат молекули.
Реакционните популярни дентални материали
Разтвор на натриев хипохлорит в стоматологията често се прилага в комбинация с други вещества, като калциев хидроксид, водороден пероксид, ETDA, лимонена киселина, хлорхексидин, и така нататък.
Реакцията с калциев хидроксид
Натриев хипохлорит е почти винаги се използва за измиване на калциев хидроксид суспензия от каналите, понякога дори за временно закрепване intrakanalnogo използва смес от калциев хидроксид и разтвор на натриев хипохлорит, което предполага, че такава смес ще бъде по-ефективна. В настоящето, калциев хидроксид и натриев хипохлорит разтвор е химически несъвместими един с друг, тъй като реагира химически, при което се образува калциев хипохлорит в разтвор на натриев хидроксид:
Ако тази техника се промива калциев хидроксид суспензия от каналите е оправдано, тъй като калциев хипохлорит и по-специално натриев хидроксид са много лесно разтворим във вода, използването на тази смес като временно закрепване безсмислено.
Реакция с водороден пероксид
Силно разреден разтвор на водороден пероксид често се използва в стоматологията и често промивка натриев хипохлорит канали редуват с промиване с водороден пероксид. Тези вещества реагират един с друг, също реакцията е много насилие и придружени с бързо отделяне на газ (кислород):
Тези вещества почти веднага неутрализират взаимно, така че тяхното редуване е смислена само за неутрализиране на разтвор или за бурна реакция с отделяне на газ, който може да помогне малко механично ясно канала.
EDTA реакция
Реакция с хлорхексидин

Взаимодействие разтвори на натриев хипохлорит и хлорхексидин. Епруветките са разтвор на натриев хипохлорит посочено концентрация във всяка епруветка се излива 2% разтвор на хлорхексидин. Двете най-подходящите Флаконите са контрол с 6% натриев хипохлорит само с 2% хлорхексидин
Реакцията на натриев хипохлорит и хлорхексидин осигурява р-хлороанилин, която пада като умерено водоразтворима ръжда-оцветена утайка (фиг. Реакцията на натриев хипохлорит и хлорхексидин). р-хлороанилин е токсичен, канцероген.
етанол реакция
Натриев хипохлорит и етанол се смесва в стоматологията рядко, въпреки някои зъболекарите смятат, че добавяне на етанол към разтвор на натриев хипохлорит ще намали напрежението на последната повърхност. В настоящето, натриев хипохлорит chlorinates етанол хлороформ. така смесването на тези вещества е нежелателно, ако няма цел да се получи точно хлороформ.
Натриев хипохлорит първо се окислява етанол до ацеталдехид и след това се превръща в хлорал (trichloroacetaldehyde):
В алкална среда разлагат хлорал да образуват хлороформ и мравчена киселина, натриева сол:
Реакцията с цинков оксид
Цинков оксид се намира в много дентални материали, като временно запечатване или фиксиране материали endodontologicheskie импрегнатори и guttaperchievye щифтове. В разтвори на натриев хипохлорит с натриев хидроксид, винаги присъства. и който може да реагира с цинков оксид съгласно следната реакция:
Реакцията със солна киселина
Солна киселина се използва в стоматологията много рядко, въпреки това, реакцията на натриев хипохлорит със солна киселина се извършва:
Бурна реакция, придружени от остра изолация интензивно отделяне на хлор по време на смесване, и продължава определено време.