Корозия на метали и борба срещу него
12. Основните видове метална корозия
Корозия - процес на разрушаване на метала под въздействието на химическата среда в контакт с него, ще се проведе на интерфейса на повърхността. За разлика от метал ерозия корозия е разрушаването на повърхността под въздействието на механично действие (например, водни струи, зърната носещи пясък, и така нататък. П.).
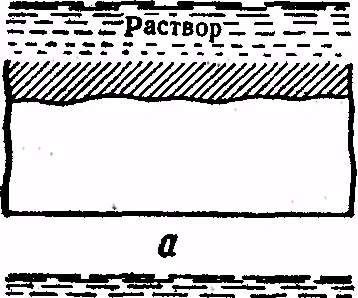
Фиг. 8. Видове корозия:
и - единна, B - блотове, - точка г - точкова корозия, образуване г - mezhkristal-litnaya д - крекинг, w - Селективен
Корозия е редокси хетерогенен процес срещащи се в интерфейса. Корозия може да се случи в газове, във въздуха, във вода (река, море, почва), в органични разтворители разтвори и електролитно-позиция. Разграничаване химически и електрохимически корозия на метали.
Мащабът на загубите от корозия са изключително високи в световната икономика. Буквално милиарди долари се изразходват в развитието на индустрията циален страни за борба с корозията на метали и подмяна извлечени-ТА корозията на метални конструкции и изделия. Така, анти-корозия метал е един от сериозност, Ther проблеми в производството и в транспорта. видове корозия са показани на Фиг. 8. Тя може да бъде еднакъв (а); местни (б - блотове, - точка ж - хлътване); interkristal-litnoy (междукристална) (г); пукнатини (д); селективен (д).
13. Видовете метална корозия
Химическа корозия - е разрушаването на метал окислението в околната среда, без появата на електрическия ток в системата.
Корозия на въздух при различни температури. Под действието на въздух или газ някои метал променя състоянието си в повърхност, естеството и степента на модификациите са както са дефинирани свойства на метала и свойствата и състав на газа носител в контакт с метала. В някои случаи, той образува само един много тънък слой от продукти (potuskne-комплект, потъмняване отгряване), но често под влиянието на газ се появява силно корозивен метали (например, Метод rzhavle депозити на желязо в влажен въздух) върху металната повърхност. При окисляването на желязото е оформен в зависимост от условията на три оксид слой съдържащи FeO, Fe3 O4 и Fe2 О3.
Когато металът окислява при повърхността слой от окси-и, които, както си сгъстяване, всички все по-усложнява достъпа на кислород към металната повърхност, така че скоростта на филма често сгъстяване не се определя скоростта на химически окисление на про-цесията и скоростите Tew дифузия на металните йони или кислород през дебелината на филма оксид.
Дифузия през оксид филм по същество зависи от наличието на дефекти. При стайна температура, филм оксид често е изо-liruet метал от достъп на въздух и последващо окисление на скоростта на метал става незначително. метал окисляване на въздуха се осъществява по-бързо при повишени температури, тъй като чрез дифузия протича оксид слой при по-висока скорост.
При нормално налягане, окисляване на метал в различни ин-температурен интервал предмет на различни закони. Например, алуминия в сух въздух бързо се покрива с филм оксид тол-schinoy около 30 Ангстрьома, след което окисляване на практика престава.
Повечето математически уравнения, описващи окисление на метали (в координати с дебелина на слоя - време) при нормални условия, да имат логаритмични или експоненциални. Например, когато - дебелината на филма; К и - константи; т - време на окисляване. Криви у = F (т) е показано на Фиг.9 (L и С). Над определен параболичен право (крива F) температура на сгъстяване оксид филм срещу температура се експресира.
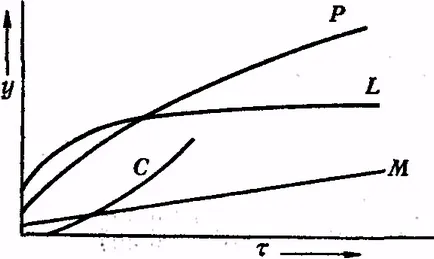
Фиг. 9. Различни видове криви P - параболична крива, L - логаритмична крива C - вдлъбната крива, права линия М
Най-простият случай на параболична закон отговаря на уравнението
където - от времето оксид дебелина Т от началото на оксид-нето, и К и К '- константи в зависимост от температурата, но не зависят от време.
В малка стойност на К (което е вярно за повечето от обичайните метал-нето на не твърде високи температури), металът на която филм оксид сгъсти parabolically може да се счита в областта да бъдат достатъчно устойчиви на окисление, филм оксид, ако не е растер-skivaetsya. При по-високи ТЕМ peratures, особено в атмосфера, съдържаща малко количество от кисел вид или само слабо окислители, окисление често остава с почти постоянна солна скорост. То може да бъде краен случай, когато скоростта на окисляване е независим от времето, след това дебелината на филма може да бъде изразена чрез уравнението neniem-растежа на окисни филми на металните кристали у = Kτ + K` (линия М в графиката)
На практика много важен про-процес на желязо корозия при атмосферни условия при обикновени темпера-тура (ръжда). Ръждясване желязо настъпва много бързо в влажен въздух. Трябва да се отбележи, че процесът отива желязо ръжда с максимална интензивност на влажност, която не отговаря напълно насищане на въздуха с водна пара. Когато скоростта на относителна влажност до 65% корозия сравнително голям, и над 65% Това повишава много бързо, обаче, относителна влажност 65% солна нарича критичната относителна влажност. Когато критично и висока влажност ръжда, е хигроскопична, силно привлича и задържа влага. Първоначално оранжево-жълта ръжда има структура гел, но постепенно образуване на кристален оксид
хидроксид (FeO) ОН. Кристализацията започва в слой ръждиво-редици, при което външната обвивка на гела, което е много крехка, разгражда в сухо състояние. Крайните продукти от процеса rzhavle-нето са а- и у-модификация FeO (OH) и Fe3 04.
Окислението на метали във въздуха се повишава в присъствието на примеси на серен диоксид, въглероден диоксид, халогени, киселини, и водна пара. Така оформен върху повърхността на метална сулфат (сулфити или сулфиди), карбонати и евентуално хидроксиди, съвместно torye разлага бързо, като вторични оксиди са по-порести и по-малко защитават метала от корозия. По време на корозия на метални играе важна роля в контакт с други метали или дори твърди вещества, като например наличието на прах върху металната повърхност. корозия на прашен въздух е значителна, но по-интензивно, отколкото в чисто пръстта.
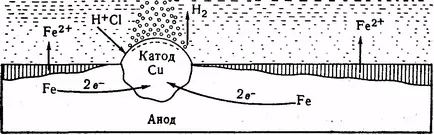
Фиг. 10. Схемата с включването на желязо корозия на мед
Галванична корозия. Унищожаването на метал в среда с електро-Lits поява в електроенергийната система се нарича електро-химична корозия. Почти всеки метал съдържа примеси от други метали. Следователно, в среда система електролит на основния метал и метал примес P образува голям брой микро-галванични клетки. Появата на тези елементи може да се обясни; Ob-базирани стойности на стандартни електродни потенциали (Таблица 3).. Всеки член на тази серия, стои по-горе има по-отрицателен потенциал от съседката си по-долу. Естествено, ако две метални проводник е за свързване на разтвора и се поставят в разтвор, съдържащ йони на тях, по-активно метала ще корозия, докато по-малко активен корозия не е под-jected.
Фиг. 10 показва плоча на желязото с медни включвания. Разтворът на електролит (HCl), тази система е поцинкована-еска елемент, който е желязо ано-къща във вътрешната верига (Е ° = - 0,44 в) и меден - катод (Е ° = 0337 в). Атомите на желязо, мед прехвърляне два електрона преминават в разтвор под формата на Fe2 + йони до средни и хлоридни йони образуват железен хлорид (II). йони водородни движат към катода (мед). Тук те поставете zhayutsya:
Полученият водород е частично запазена катодната повърхност е частично отстранен под формата на мехурчета. Ако не се подаде на кислорода на катод, а след това постепенно започва своята поляризация. катод потенциал става все по-негативни, и в крайна сметка в сравнение с потенциала на анода, което води до спиране на тока и корозия. В SLE-чай свободен въздух на кислород към катода настъпва депо поляризация на
и електрохимичен процес корозия върви гладко. Ако това галваничен елемент вместо солна киселина, за да се направи разтвора на натриев хлорид, като цяло по време на процеса не са се променили. Почести, че ще бъде само вторични реакции. В катода, освен водород, се образува натриев хидроксид: