
Възможно ли е да "съживи" изчерпаните батерията. Някои майстори знаят как да го направите: през изтощена батерия суха ток специални импулси се предава. Тази операция понякога върши няколко пъти. Въпреки това, тя възстановява накратко елемента. Чакай, чакай! Каквото и да е, се оказва, че един галваничен елемент - същата батерия! Зареждането електрическия шок, възстановяване, ние се натрупват енергия в нея, които могат след това да похарчите. Вярно ли е това? Оказва се, че или не. На първо място, не всеки елемент може да се презарежда. Невъзможно е да се направи това, например, с един елемент, в който има два течен електролит. Един пример е Daniel елемент, при което две различни течности разделени от порест чаша. Постепенно се просмуква през стъклото, електролитите са смесени, реагират един с друг и излъчват ток. Този елемент, ако той вече е изпълнил мандата си, не се е възстановил. Други елементи с твърди електроди презареждане, магазин енергия по принцип, но на процеса на натрупване на толкова нерентабилна и неефективно, че мнозина смятат, че не е необходимо. Натрупването само незначителна част от електрическата енергия, подавана към елемент и на самия елемент и след няколко такива chargings унищожени. За да се превърне в добър диск, на галваничен елемент трябва да бъде достатъчно добър за извършване на процеса на зареждане. Това най-накрая успя в средата на ХIХ век. През 1859 г. френският учен и инженер Гастон Plante прекара интересно преживяване, външно много прилича на опита на Volta. Както Волта, Plante конструирана електрохимична клетка, обаче, тъй като тя се два електрода оловни плочи, при нормални условия, покрити с филм на олово оксид. Електролитът е същата - разредена сярна киселина. Plante свързан към електродите на постоянен източник на ток и известно време премина ток чрез своя елемент, точно като при презареждане сухи клетки. Тогава той се изключва тока и свързани с електродите на галванометър. Устройството показва, че самият елемент Plante стана генерира електрически ток, и по този начин открои почти цялата енергия, изразходвана за упражнения. Зареждането може да се повтори на голям брой пъти - винаги елемент работи добре, не унищожават, подобно на сухи батерии. Това електрохимична клетка е наречен елемент от втория вид, или батерия. Тъй като енергията се натрупва в батерията Plante? Когато ток преминава през електролита на сярна киселина при водеща плоча свързан към отрицателния полюс на източника на захранване - катода, водород се освобождава, което възстановява оловен оксид в чисто олово. Електродът свързан към положителния полюс - анода, кислород се освобождава, което се окислява оловен оксид на пероксид. Батерията е заредена, когато катода ще бъде напълно чисто олово, и анод на - олово пероксид. След това ще най-голямото напрежение между електродите. Свързване плоча-електрод проводник с мощност на потребителските разходи, ние ще изтощи акумулатора. текущата посока на изпълнение, когато обратното на това, което беше по време на зареждане. Положително заредени плоча ще се възстанови водород и отрицателно - окисляем с кислород. След като плочите ще бъдат същите, батерията спира даде ток. Необходимо е да се повтаря упражненията. Ясно е, че енергията в батерията се съхранява под формата на осезаем вещества - олово, подвижен с освобождаването на енергия в главната пероксид. много натрупване на енергия и освобождаване процес става тук по различен начин, отколкото в чисто електрически батерии - кондензатори. Следователно, като батерия се нарича електрохимичен.
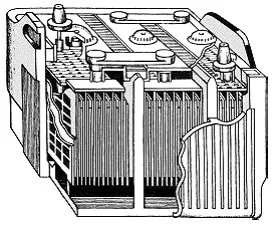
Фиг. 1-кар батерия олово киселина
В дизайни батерии автомобилни оловно-киселинни (фиг. 1), много изследователи са се опитали да се увеличи повърхността на електрода е възможно без да се компрометира здравината на тях. В крайна сметка на площта на повърхността зависи от енергията на батерията. Сега акумулаторните плочи са направени под формата на олово мрежи покрити с олово пероксид (положителен електрод) и гъба олово (отрицателен електрод). Електролитът е 25-35% воден разтвор на сярна киселина. Натоварени акумулатор има напрежение (по-точно - на електродвижещата сила) на клемите на 2 - 2,2 V. При освобождаване това напрежение пада, и когато достигне 1.8 V, освобождаване обикновено се спира, в противен случай решетка може да доведе също разреден по време на реакцията, и плочи, загуба на сила, се разпада. Искаш ли да знаеш какво ще се случи с батерията, ако се опитате да получите най-малко в краткосрочен план с висока мощност ток от него? След това завъртете стартера, се захранва с батерия, но без доставка на гориво към двигателя. Двигателят, разбира се, няма да започне, и след 15-20 секунди, стартера започва да си почиват. Малко по-късно, той се спря. Тя ще завърши с впечатлението, че батерията е мъртъв, и повече от това да "изтръгне" не може да бъде всичко. Но след това, след няколко минути, стартера ще работи отново! Къде са сили в батерията? Той може да не като живо същество, за да се отпуснете? В действителност, поведението на батерията и живия организъм са поразително сходни. Когато мускулната умора от работата им сила е рязко намалява, а това отнема време, така че тя да се е възстановил. Човек ще направи много повече, ако тя ще работи равномерно, с постоянен, но с малко натоварване власт. Например, ако се опитате да тичам нагоре на 20-ия етаж на къщата, с е малко вероятно да успее един път, тя се нуждае от почивка. Да, и уморен след това ще се усети значително. И ако отидете тихо, 20-те етажа могат да бъдат преодолени без много умора. И в акумулатор: когато са включени в голям капацитет сярна киселина, която е в порите на пластините бързо използвани в реакцията се трансформира във вода, и изолиране на настоящите спира. Едва след известно време, когато сярна киселина се постепенно отново запълни порите, може да изтощи акумулатора отново. Ето защо, се зарежда и разрежда батерии (това се отнася за почти всички видове електрохимични батерии) обикновено с достатъчно малки токове на натоварване и малки за дълго време - няколко часа. Тук се намира един от основните недостатъци на електрохимични батерии - ниската си мощност на 1 кг тегло на батерията, така наречената енергийна плътност или плътност на мощността. Оловно-кисели батерии са доста икономични, но те са капризни, често нетрайни, краткотрайно. Освен олово - сравнително рядко и скъпо метал и киселина е опасно да се справя. Разбира се, че учените започват да търсят нови материали и нови принципи на живота на батерията. Така че е вторият основен вид електрохимични батерии - алкални батерии. ги направите това е тясно свързано с името на известния американски учен и изобретател Томас Едисън (1847-1931).



