Kachanovskii д
II) Приложение към лабораторна работа № 9 "Реакцията на Belousov -. Zhabotinsky" Качествени реакции партида.
III) Оптична активност на биологични молекули.
IV) Количествено определяне на протеин в разтвор.
L А Б О R A T O R I A N P А Б С Т А №1
изолиране на ДНК.
Цел: Да се изследват основните принципи и практическите техники за изолиране и пречистване на ДНК от растителни и животински тъкани.
D B д п д
Теоретичната част от работата е взето от успехите на съвременната биология ОБЕМ 91 (1981), кн. 1, стр.49 - 59 / съвременните методи за изолиране на ДНК от ВИСШИ РАСТЕНИЯ Miroshnychenko GP Дяченко L. F.
Към днешна дата, имаме доста голям набор от методи за екстракция и пречистване на растителна ДНК, както и тези методи продължават да се развиват и да бъдат променени по отношение на нови обекти на изследване. Използване на метод за изолиране на ДНК се определя, от една страна, спецификата на материала под изследване, и на второ място, тези, които имат за цел: получаване на общо, ядрени, хлоропластен ДНК или други й лекарства. Ядрена ДНК обикновено е от най-голям интерес, тъй като тя служи като матрица за генна транскрипция. Приложение 5 показва схема на регулацията на генната транскрипция.
Получаване на ДНК от митохондриите и пластиди на растителни клетки достатъчно специфични. В тази работа ние се обърне внимание, използвани за изолиране и пречистване на общата ДНК препарати методи, както и ядрената ДНК от тъкани на висши растения.
За предпочитане се изолира ДНК от прясно растителен материал, който веднага се замразяват с течен азот, като по този начин инхибиране на ДНК-аза. Замразения в течен азот тъкани и органи на растения понякога съхраняват до изолиране на ДНК, при -20 ° С А замразен материал може да се раздробява на прах, се лиофилизира и се съхранява при стайна температура с изключване на влага. Дори разработен метод за изолиране на ДНК от растителна обекти определи-Rowan алкохол.
Началната фаза на процеса на извличане на ДНК - разрушаване на клетъчните мембрани. Съществуващите методи за разрушаване на тъканите могат да бъдат разделени в три групи: 1) механично смилане, смилане, хомогенизиране; 2) използване на ензими, по-специално, разкъсвайки компоненти на клетъчната стена; 3) комбинация на механично разрушаване на ензимно разграждане. За хомогенизиране на тъканите с помощта на специални раздробяване с ножове въртящи се с висока скорост: 10-40 хиляди оборота / мин .. Този метод е за предпочитане да се прилага за млади, лесно разпада растителни тъкани. Фиксирана материал се хомогенизира в присъствието на етанол.
Задоволителна механично разрушаване на тъкани може да се постигне чрез смилане в хаван охладени със солна киселина промитата кварцов пясък, алуминиев прах, натрошени стъкло. Методът се използва широко за унищожаване на различни тъкани, особено вегетативни и генеративен органи грах миши грах, тютюн, ябълки, крем, лук меристематични тъкани на разсад маруля. Тя се използва за унищожаване на лиофилизирания материал. По-рядко срещани беше начин да се разрушаване на клетките от различни преси.
През последните години започна да се развива активно ензимни методи за унищожаване на клетъчните мембрани, което води до изготвянето на протопласти. Несъмнено им предимство - липса на нежелани остри механични ефекти, което води до разграждане на високо полимерни ДНК молекули. Това е много важно, ако искате високо полимер ДНК, например, за изучаване на неговата репликация в клетката за по-нататъшна работа. Освен това, чрез използване на протопласти увеличава добива ДНК чрез намаляване на загубата на различни етапи на пречистване на полизахаридите, което позволява да се намали количеството на изходния материал до няколко грама. Въпреки това, за всички свои качества, този метод на извличане на ДНК от протопласти трудно да се получи се протопласти.
Предвид на химическия състав на клетъчните стени, като се използва различен pekto- и целулозолитични ензими за тяхното лизис. Първо, тъканта е смачкано с помощта на пектина. Най-активни сред известни пектинази - matserozim изолира от гъбата Rhyzopus, малко по-малко активно лекарство pektinol R-10. Унищожаването на клетъчните стени се извършва в среда, съдържаща 0,4-0,7M манитол или сорбитол, с така наречените целулазните комплекси - ензим комплексни системи, които включват С1-Сх-ензим и ензим целобиаза и хидролизиране различни видове връзки в молекулите на полизахариди. Ефикасността на целулаза комплекс зависи от наличието на всички три, и евентуално повече от отделните компоненти. Целулаза комплекси, изолирани от различни източници, по-известен под техните търговски марки. Широко използвани, например, лекарства "Onozuka R-10" (Япония) и "Sellulysin" (САЩ), получена от Trichoderma viride, «Sellulase" (САЩ) - на Aspergillus нигер; местната промишленост произвежда tsellokandin ензимни препарати, Celloviridin, tsellolignorin и ksilanigrin и ксиланаза секретира от различни микроорганизми. Тези лекарства могат също да бъдат използвани за получаване на протопласти от висши растения.
Обикновено, успешен клетъчна стена лизисен експериментално за всяка тъкан избран състав и концентрация на разтворите, рН на състава и концентрацията ензим, инкубационното време и температура. Оптимални условия за получаване на протопласти са разработени за различни материи.
Според литературата, протопласт добив е над 95%. Протопластите са лесно унищожени от осмотичен шок или детергенти. В този случай, Хомогенатът се прехвърля непокътнати ядро и различните клетъчни органели. Лизис протопласти също могат да бъдат проведени в присъствието на детергенти, като например Triton Х-100, Nonidet Р-40.
Получаване на растителни протопласти, използвани като междинно препаративна изолация хлоропластен и ядрената ДНК на. Когато този лизат се центрофугира протопласти от захарозен плътностен градиент за разделяне и получаване на субклетъчни органели от тях чисти ДНК препарати. Трябва да се отбележи, че изискванията за протопласти, предназначени за изолиране на ДНК от тях са различни от изискванията, ако е необходимо по-нататъшното им култивиране, когато на преден план проблема за запазване на жизнеспособността на протопластите.
Обобщавайки по-горе, може да се заключи, че методът за избор на унищожаване на растителните тъкани определя от краен работа задача, тъканна специфичност и други причини. За унищожаване на деликатни ембрионални тъкани полезен хомогенизиране, смилане в хаван. Фиксирана материал или тъкан със силни клетъчни стени трябва да се смила в мелница хоросан или чрез замразяване с течен азот. За изолиране на отделните видове ДНК (ядрени, хлоропласт), най-подходящите методи за ензимно разрушаване на клетъчните мембрани.
За високо полимер лекарство за инхибиране на ДНК освободен по време на разрушаване на клетките нуклеаза. Приблизителният състав на клетки е показан в допълнение 2. За да се намали нуклеаза процес разпределение активност се провежда в студен (0 ° до + 2 ° С), в които не са оптимални за своите действия алкална среда. Когато среда хомогенизиране се въвежда в EDTA за тъканни инхибитори, натриев цитрат, и други съединения, които се свързват Mg 2+ йони. необходими за действието на аза. В различна степен инхибират дезоксирибонуклеаза арсенат йон, флуорид и натриев хлорид при високи концентрации, фенол, р-аминосалицилова киселина (4-амино-2-хидроксибензоена киселина), детергенти, бентонит. Той е активен инхибитор на ДНК-аза aurintrikarbonovaya киселина в концентрации от 10-50 тМ. Освен това, поради термична лабилност дезоксирибонуклеаза частично денатурира чрез нагряване в тъкан лизати при 55-60 ° С
За получаване на обща ДНК след разрушаване на тъкан клетъчен лизис се извършва и ядрените мембрани. Както лизиращия агент се използва най-често с натриев додецил сулфат (SDS) (п-S12N25SO4Na) при концентрации от 1-5%. SDS насърчава лизис на мембрани и ядра увеличава добива и подобрява ДНК депротеинизация. SDS Deproteiniziruyuschy ефект е, че за свързването му към протеинови комплекси, образувани са разтворими. SDS силно нарушава водород и хидрофобни връзки в протеинови молекули, се разтваря много рано разтворими протеини. SDS протеинови комплекси стават значителен отрицателен заряд поради йон додецил сулфо.
Хидрофилният регион на протеина
Фиг. 1. Действие детергент разтваряне с мембранен протеин. В зависимост от съотношението на протеин и детергент разтворен протеин в разтвор може да бъде в положението, показано на фигурата, или да образуват комплекс с детергент мицел.
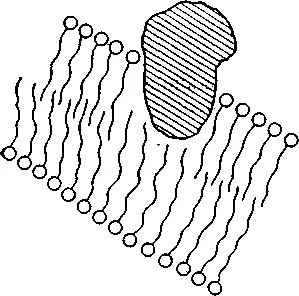

Освен SDS, и други детергенти се използват за лизиране тъкан: 1% triisopropylnaphthalene (изо-С3 H7) 3 С10 Н4 SO3 Na, 1% цетилтриметиламониев бромид (C16 H24 (CH3) 3 М + Вг -) (цетримид) 4% натриев dodetsilsarkozinat (C11 H21 CON (CH3) CH2 SOONa) (саркозил). Всеки един от тях има своите предимства и недостатъци. SDS утаява на студено и в присъствието на калиев. Саркозил неразтворим в студена, но образуват неразтворими соли с Mg2 + и Mn2 +. Triisopropylnaphthalene активно инхибира нуклеази, но също образува неразтворима сол с магнезий и манган. В допълнение, през последните два препарат интензивно поглъщат светлината при 260 нм. натриев Dodetsilsarkozinat използван в случая, където планираното допълнително пречистване в цезиев хлорид ДНК, тъй като за разлика от SDS разтваря в солта.
В допълнение към детергенти, в смес лизиране понякога прилагат протеолитични ензими от бактериален произход, не губят активност при повишена температура (60 ° С). Особено ефективен протеиназа К ( "Сигма", САЩ), който има много широка субстратна специфичност. Активирането на този ензим е повече от 7 пъти в присъствието на урея и SDS се дължи главно на денатурация на протеин-субстрати при тези условия.
След лизис обикновено се извършва многократно депротеинизация Полученият лизат. Когато това се случи унищожаване на химическите връзки носещата конструкция на тройна и кватернерна протеин (видовете и енергийните отношения в биологични молекули са изброени в приложение 3). За тази него различни връзки за дисоциация на нуклеопротеин комплекси се прибавя (NaS1, NaS1O4. Карбамид), последвано агенти, денатуриране протеини. Избор агенти deproteiniziruyuschih определени от специфичните условия и целите на по-нататъшната работа с секретирани ДНК препарати.
Въпреки широко разпространените методи за ДНК депротеинизация с фенол и хлороформ има редица сериозни недостатъци. Един от тях се състои в разрушаването на високо полимерни ДНК молекули в фрагменти чрез механично разклащане deproteiniziruyuschimi с тези средства. Освен това, има доказателства, че селективно извлича фенол сателитна типа ДНК-AT, води до увеличаване на загубата на ДНК по време на изолирането. Обработка фенол 10% намаляване на вискозитета на ДНК, понижава точката на топене, това води до промени в GC-богат региони двойки. При използване на загуба хлороформ, свързани с мембрани или хетерохроматин ДНК могат да се появят. Количествено определяне на нуклеинови киселини загуби, дължащи се на двойно третиране с фенол и хлороформ, беше установено, че губи около една четвърт от ДНК. При двойно третиране със загуба хлороформ ДНК е 16%. Хлороформ селективно извлича едноверижна ДНК:
54%, когато трите лечения.
ДНК загуби, причинени от лечение с фенол и хлороформ, може да се избегне чрез използване на препаративна SsSl градиенти. Плътност градиент ултрацентрофугиране позволява да се получи високо пречистени ДНК препарати. SsSl наличие на висока концентрация (2-4 М), заедно с 5 М урея понякога води до пълно разпадане на нуклеопротеин комплекс. Принципът на метода за почистване се състои в това, че ДНК и примеси (RNA, протеини, полизахариди) се различават по плаващ плътност. SsSl и центрофугиране плътност условия са избрани така, че РНК се утаява на дъното на повърхността протеин и ДНК се намира в близост до центъра на тръбата.
Този метод не е толкова просто или икономически ефективен от гледна точка на времето и оборудване, но стойността му се крие във факта, че тя е много ефективна в присъствието на малки количества от изходния материал. След пречистване чрез равновесно центрофугиране в SsSl ДНК препарати съдържат <1% РНК, <1% белка, характеризуются высоким гиперхромизмом, гомогенностью по молекулярному весу. Кроме того, очистка в градиенте СsСl позволяет избавиться от некоторых примесей, влияющих на скорость реассоциации ДНК.
Ефективно почистване на препаративни количества от ДНК на растенията може да се извърши в плътностен градиент SsSl смес и етидиев бромид. Етидиев бромид прави видима ивица на ДНК и позволява да инхибират хидролизата на ДНК.
За разлика от ДНК методи на извличане с градиентно центрофугиране с използване на методи SsSl депротеинизация с фенол хлороформ и изисква допълнително пречистване на РНК от примесите на препарата. Традиционният метод на ДНК пречистване на РНК - ензимно разграждане на последната в присъствието на панкреатичната рибонуклеаза А; в някои случаи, включващ още използване на RNase Т1. Едновременно с RNase понякога се препоръчва да се използва α-амилаза за отстраняване на остатъчните полизахариди в състава. Промени в разтвора на ДНК отстраняват ензими депротеинизация с фенол или хлороформ и ДНК се утаява с изопропанол.
Чрез използване на методи за изолиране на растителна ДНК, които се основават на процедура Marmur, е възможно да се получат задоволителни ДНК препарати пречистени, но добивът на ДНК е относително ниска (10-20 мг / кг пресни листа).