Изследване на протеин денатурация под въздействието на йонни детергенти - резюме, страница 1
1. Протеини и тяхната структура. 3
2. денатуриране протеин 8
3. Detergents 10
4. денатурация от йонен детергент 12
1. Протеини и тяхната структура.
Протеин - полимерни молекули, в който мономерите са аминокиселини. Пептидни вериги съдържат десетки, стотици или хиляди аминокиселини, свързани с пептидни връзки силни. Поради междумолекулни взаимодействия на протеини образуват определена пространствена структура, наречена "конформация на протеини." Линейната последователност на аминокиселини в протеина съдържа информация за изграждане на триизмерна пространствена структура. 4 нива на структурна организация на протеини, наречена първична, вторична, третична и четвъртични структури (фиг. 1.1). Има общи правила, които е налице образуване на триизмерни структури на протеините.
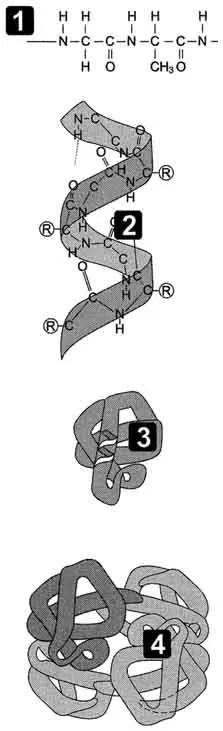
Фиг. 1.1 - Етапи на протеин конформация. 1 - първична структура; 2 - вторична структура; 3 - третична структура; 4 - четвъртична структура.
Аминокиселинните остатъци в пептидната верига на протеини не се редуват произволно, и са разположени в определен ред. Линейната последователност на аминокиселинни остатъци в полипептидните вериги се наричат "първична структура на протеина."
Всяка от 50-човешкото тяло 000 отделни протеини е уникален за протеин първична структура. Всички отделни протеинови молекули имат същото редуване на аминокиселинни остатъци в протеин, който основно се отличава индивида от всеки друг протеин.
Линейни отделни полипептидни вериги на протеини, поради взаимодействие на функционалните групи на аминокиселини придобиват известна триизмерна пространствена структура, наречена "конформация". Всички индивидуални протеинови молекули (т.е., със същата основна структура) за да се образува еднороден разтвор конформация. Следователно, цялата информация, необходима за образуване на пространствени модели съхраняват в първичната структура на протеини.
Протеините се различават два основни типа конформация полипептидни вериги: вторичната и третичната структура.
Вторичната структура на протеини - пространствената структура, образувана в резултат на взаимодействието между функционалните групи на членовете на пептидния скелет. По този начин, пептидни вериги могат да придобиват редовни структури на два вида: α-спирала и β-структура.
Най-
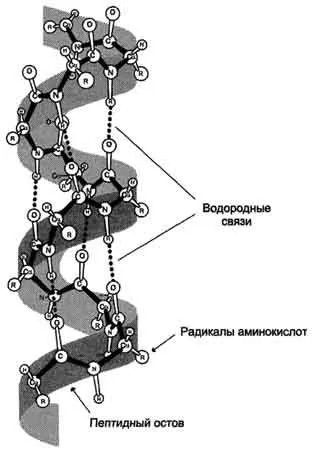
При образуването на водородни връзки са включени в почти всички кислород и водородни атоми пептидни групи. В резултат на α-спирала "извади заедно" няколко водородни връзки. Въпреки факта, че данните за комуникация принадлежи към категорията на слабите, броят им осигурява възможно най-голяма стабилност на α-спиралата. Тъй като всички хидрофилни групи на пептидния скелет обикновено участват в образуването на водородни връзки, хидрофилността (т.е., способността да образува водородни връзки с вода) а-спирали намалява и увеличава тяхната хидрофобност.
Фиг. 1.2- -спиралата. Фигурата показва пространствената структура -spiralized част от полипептидните вериги и образуване на водородни връзки, които участват в образуване -спирала.
-Структурата се образува чрез образуване на множество водородни връзки между атомите на пептидни групи от линейни участъци на единична полипептидна верига, като завоите, или между различни полипептидни вериги, β-структура образува фигура подобен на лист, прегънат "хармоника", - р-нагънат слой (Фигура 1.3. ).
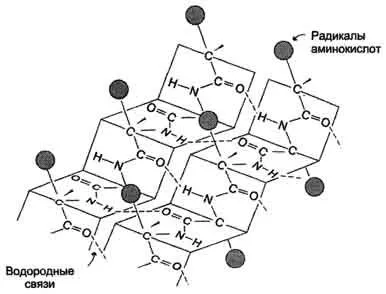
Фиг. 1.3 - Вторичната структура на протеини под формата на β-нагънат слой.
Когато водородните връзки, образувани между атоми на пептидния скелет на различни полипептидни вериги, по-нататък между верижни връзки. Водородни връзки, които възникват между линейните участъци в единична полипептидна верига, наречени вътреверижни. В структури -водородна връзка разположени перпендикулярно полипептидна верига.
Протеин третична структура - триизмерната пространствената структура, образувана в резултат на взаимодействието между радикалите амино киселини, които могат да се намират на значително разстояние един от друг в полипептидната верига.
При полагане на полипептидната верига на протеина има тенденция да стане енергично благоприятна форма, характеризиращ се с енергия минимум свободен. Следователно хидрофобни амино радикали са склонни да се обединят в глобуларна структура на водоразтворими протеини. Между тях са така наречените хидрофобни взаимодействия и ван дер Ваалс сили между тясно съседни атоми. Като резултат, хидрофобна сърцевина се образува вътре протеин глобули на. Хидрофилните групи на пептидния скелет в образуването на вторични структури образуват множество от водородни връзки, като по този начин се избягва ги направи с вода и унищожаване на вътрешна плътна структура на протеина.
Хидрофилни амино радикали са склонни да образуват водородни връзки с вода, и следователно са разположени главно по повърхността на молекулата на протеин.
Всички хидрофилни групи амино радикали капан в хидрофобно ядро, да си взаимодействат един с друг чрез йонни и водородни връзки.
Йонийски свързване може да възникне между отрицателно заредените (анионен) карбоксилни групи на аспарагинова и глутаминова киселина радикали и положително заредена (катионен). Водородни връзки се появяват между незаредени хидрофилни групи (като -ОН, -CONH2. SH-групи), и всякакви други хидрофилни групи. Протеини функциониращи в неполярен (липид) среда, такива протеини са обратният устройството: хидрофилни амино радикали са разположени във вътрешността на протеина, докато хидрофобните аминокиселини са локализирани по повърхността на молекулата и в контакт с неполярен среда. Във всеки случай, радикали аминокиселинни заемат най-изгодно положение на биоенергия.
Няколко третична структура на протеините се стабилизира дисулфидни връзки, образувани в резултат на взаимодействието на двата SH-групи на цистеинови остатъци. Тези два цистеинови остатъци могат да бъдат раздалечени в линейната първичната структура на протеина, но образуването на третична структура, те се събират и образуват силни свързване ковалентни радикали.
Повечето интрацелуларни протеини липсва дисулфидни връзки. Въпреки това, тези съобщения са често срещани в протеини, секретирани от клетките в извънклетъчното пространство. Смята се, че тези ковалентни връзки стабилизират формирането CON на протеини извън клетката и предотвратяване на тяхното разграждане. Тези протеини включват хормона инсулин и имуноглобулини.
Всички протеини със същата основна структура, които са в същите условия, същото печалба характеристика на отделните протеин конформация определят специфичната си функция. Функционално активна конформация на протеина се нарича "нативна структура".
Ако полипептидната верига на протеина съдържа повече от 200 аминокиселини, обикновено, неговата пространствена структура, образувана във формата на две или повече домени. Домейн - част от полипептидната верига, която след образуване на пространствената структура на независимо придобити от други части на същия образуването CON верига на глобуларен протеин. Така, G имуноглобулинова лека верига се състои от два домена. В някои случаи, името на домейна е отделните структурни части на полипептидната верига.
Домейни могат да бъдат идентифицирани като цяло чрез въздействие върху протеина от протеолитични ензими, лесно разкъсване пептидни връзки в частта на полипептидна верига, разположена между домени. След това, някои области могат да запазят техните биологични свойства.
Много протеини съдържат в състава на само една полипептидна верига. Такива протеини се наричат мономери. Към мономер и включва протеини, състоящи се от няколко схеми, но са ковалентно свързани като дисулфидни връзки (по този начин инсулин трябва да се разглеждат като мономерен протеин).
В същото време, има протеини, състоящи се от две или повече полипептидни вериги. След образуване на триизмерната структура на всяка полипептидна верига се комбинират като се използват същите слаби взаимодействия, които са участвали в образуването на третична структура: хидрофобна, йонни, водород.
Броят и относителната позиция в пространството на полипептидни вериги, наречен "кватернерна структура на протеини." Отделните полипептидни вериги в протеин се наричат протомери или субединици. Протеини, съдържащи в състава си повече протомери, наречен олигомерен. Съставът може да включва олигомерни протеини от два до няколко десетки протомери, въпреки че най-често изпълнени от протеини, съдържащи два до четири полипептидни вериги (димерни, тетрамерни протеини).
Протеините играят централна роля в изпълнението и регулиране на почти всички жизненоважни процеси, протичащи в живите организми на молекулярно ниво, така че проблемът за връзката на структурата и функцията на протеинови макромолекули е един от централните проблеми в съвременната наука. За протеините ефективно да осъществяват тяхната функция, изисква определена стабилност на протеин макромолекула. макромолекулата на протеин, способен да претърпява структурни промени под влиянието на различни средства.