Хетерогенни константа на равновесие разтворимост
Според теорията на силни електролити, когато разтворени вещества, чиито кристали са изградени от йони не е молекулата, и йоните образуващи кристалната решетка в разтвор. Следователно, в наситен разтвор на такива съединения е установено равновесие между йоните са преминали в разтвор и твърда фаза (утайка) на разтвореното вещество. В този случай две взаимно противоположни процес поток: движи йони от утайката от разтвора (разтваряне) и се утаява от разтвор (кристализация).
Наситените разтвори на слабо разтворими електролити са силно разредени. Тяхната йонна сила е малко, така че можем да предположим, че коефициентите на активност на йони на електролити в разтвор са равни единство и тяхната собствена активност с еднакви моларни концентрации числено.
е установен подвижно хетерогенна равновесие - умерено разтворим сребърен хлорид наситен разтвор на сол между AgCl на утайка и йони са в течна фаза и Ag + Cl:
AgCl (т) Ag + (п) + Cl - (р)
Съгласно закона за действието на масите, количествено се характеризира с константа на равновесие:
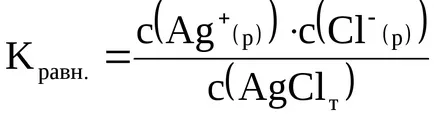
Като се отървете на фракцията, изразът за Kravn. може да се запише по следния начин:
Тъй като С твърдо концентрация (AgCl (т)) е постоянна, след това лявата страна на това уравнение с постоянни външни условия (температура, налягане) също ще бъде постоянна. Продуктът от тези константи (Kravn х С (AgCl (т)).) Се нарича inachekonstantoy разтворимост и oboznachayutKs (индексът «а» на Engl разтворимост - разтворимост.):
В руската литература често се използва вместо константата на разтворимост, наречена "разтворимост продукт" и oboznacheniePR iliKPR
В момента на определянето PR и Кат. препоръки на IUPAC не са подходящи да се прилагат.
От експресията на константите на разтворимост следва, че съществува постоянна при дадена температура в наситен разтвор на разтворим електролит продукт на моларната концентрация на йони.
Ако няколко идентични йони, образувани чрез дисоциация на електролита с формула единица, например:
Са3 (РО4) 23Ca 2+ + 2PO4 3-,
при изчисляването KS равновесие моларна концентрация на всеки йон се повишава до мощност, равна на стехиометричното съотношение, което се намира в предната част на дисоциация уравнение дава йон
Такъв продукт на моларните концентрации на йони в бъдеще ще nazyvatstehiometricheskim работа.
Така за всеки разтворим електролит
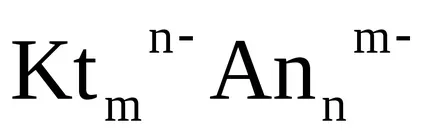
разтворимост константи, както и всички равновесната константа, температурно-зависим, така че в справочници те често са дадени за стандартни условия (Т = 298К и р = 101,325 кРа) (Таблица. 14).
Таблица 14. константи разтворимост на някои слабо разтворими вещества, при Т = 298 К