Броят на нуклоните в ядрото на един атом е равна на елемент относителна атомната маса на елемента, закръглена
Водородът Аг = 1001; 1 нуклон
Въглероден Аг = 12011; 12 нуклоните.
Нуклиди изотопи на масовото число
Повечето елементи в природата, се състои от няколко типа атоми с различни стойности на относителната атомната маса.
Пример. Хлорът се намира в природата като смес от два вида атома, един от които съдържа 18, а другият - 20 неутроните в ядрото.
Всеки вид атоми (тип ядра) е нуклид. Нуклид - е вид атоми и ядра, заредете определен брой протони и неутрони.
Нуклиди, принадлежащи на един елемент и е уникално определят от броя на протоните, но различни неутрони в брой, наречени изотопни нуклиди. или просто изотопи.
Изотопи елемент - е нуклиди с равен зареждане на ядрото (брой протони). Изотопи елемент се различават само в броя на неутроните и следователно, общият брой на нуклоните.
Пример. Ядрата на две естествени изотопи на хлор съдържат 17 протони, но 18 и 20 неутрони, т.е. 35 и 37, съответно нуклоните.
За нуклиди точните стойности на относителните атомните маси са винаги в близост до стойност цяло число, така че масата на нуклиди могат да бъдат сравнени с тези стойности, наречени масовото число.
Нуклид масово число, равно на броя на нуклоните съдържащи се в него (сумата от протони и неутрони).
специални символи, използвани за обозначаване на специално нуклиди. ядрен заряд (поредният номер на елемента) - номер на маса, а индексът на ляво на горния индекс показва символа на химичния елемент. Например, хлор-18 изотоп е написано като.
Маса брой = брой на нуклоните в ядрото.
Пореден номер = броя на протоните в ядрото или броя на електроните в черупката на атом.
Разликата между броя на маса и серийния номер = броя на неутроните в ядрата.
Структурата на електрони обвивка на атома. нива на енергия
Структурата на електрони обвивка на атома определено различно енергийно съдържание Е на отделните електроните в атома. В съответствие с модела на Бор на атома, електрони в атома могат да заемат позиции, които съответстват точно определена (квантувани) енергийни състояния.
Броят на електрони, които могат да бъдат на отделен енергийно ниво, определен от формула 2n² на. където п - номер на ниво, което е обозначено с арабски цифри 1-7; се отнася също букви използват енергийни нива от К до Р. Максималната пълнене първите четири нива на мощност в съответствие с 2n² формула е: за първо ниво К - 2 електрони, втората L - 8, третият M - 18 и четвърто ниво N - 32 електрон.
Quantum - механично обяснение на структурата на атома
Orbital модел на атом
Съвременните квантовомеханични идеи за структурата на електронната обвивка на атома въз основа на факта, че движението на електрон в атома не може да се опише определена траектория. Възможно е да се разгледа само един определен обем от пространството, в която електрона. Тъй електрона има и частица и вълна свойства, подходът към обяснението на структурата на електрони обвивка може да бъде или теория еритроцитите и теория вълна; и двете водят до същия интуитивен представяне, формулиран като орбиталната модел на атома.
1. Обосновка на орбитален модел на атома, електрони, произтичащи от еритроцитите природата. Това е, както следва. Както се вижда от фиг. 2. вероятността електрона в атомното ядро е нула, е в близост до ядрото е малък, но бързо нараства с увеличаване на разстоянието от сърцевината. На известно разстояние вероятността достига максимум и след това намалява бавно асимпотично близо до нула разстояние до безкрайност. Така, не е възможно да се ограничи пространството, в което електрона може да бъде, т.е. не може (без условия) се определя от размера на атом. Въз основа на еритроцитите характер на електрона може да се говори за 90% вероятност за престой в ограничено пространство, което се нарича атомна орбитална а.
Фиг. 2. зависимостта на плътността на електрони (или вероятността за намиране електрон на разстояние R ядро-електрон) в един атом на разстояние от ядрото
2. Обосновка на орбитален модел на атома, който идва от вълна характер на електрона. Това е, както следва. Електрон запълва пространството около атомното ядро под формата на постоянна вълна, която може да бъде представена графично като електронен облак. Плътността на електронен облак, облакът разбира като електрическия заряд на електрон - гъстота електрон - ще бъде различна и зависи от разстоянието на електрон-ядро (фиг.1). Докато ограничаване на електронната плътност до стойност
90% получен същия орбитален модел на атома.
Атомна орбитална - геометрична фигура, съответстващ на обема на пространството около ядрото, което съответства на вероятност за намиране на електрони в този обем (като частици) 90%, докато зареждане на електронната плътност 90% (като вълни).
Модел на атомни орбитали (електронен облак) е много удобно за визуално описание на разпределението на електронна плътност в пространството. Когато това е-орбиталния има сферична форма, стр орбитален - гира форма, г-орбиталния - chetyrehlepestkovogo цвете или двойно гира, F-орбиталния - по-сложна форма (фигура 3.).
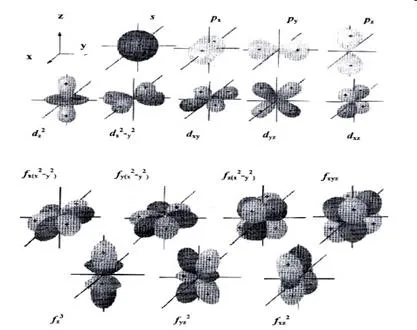
Фиг. 3. форми на s-, р. D- и F орбитали
Ако атомна орбитала е само един електрон (както в водороден атом), тогава се говори за един или полу-заети, poluzaselennoy атомна орбитала. Ако в атомните орбитални два електрони (например в хелий атом), ние говорим за двойно заети или изцяло запълнени, напълно населените атомна орбитала. Poluzaselennye АД играят решаваща роля във формирането на химични връзки.
В съответствие с квантово-механично състояние на електрона в описание атом всеки електрон е индивидуална частиците. Неговите свойства като маса и заряд не показват разлики между електроните, особено между електроните, които са на същата атомна орбитална (както в хелий атом). Присъщите характеристики на всеки електрон на атом е спин.
Две електроните в един атомни орбитали се различават в гърба.
Spin - на квантовите механични свойства на електроните, които не могат да бъдат точно обяснени с традиционните концепции, базирани на механичното поведение на частици. С изключение на вълната свойства на електрон въртене може да се тълкува в сравнение с електрон топката върти около ос избран. Spin характеризира посоката на въртене, а оттам и за двете възможни посоки на въртене механични трябва да съществуват две различни електронен спин.
Spin - основна характеристика на електрон на атом; два електрона в една атомна орбитална имат противоположни завъртания.
Атомна орбитална удобно представени под формата на квадрат, наречена квантова клетка, и всеки електрон - вертикална стрелка показва един от два електрона завъртания. Quantum клетка с единична стрелка показва атомна орбитална на един електрон, т.е. poluzaselennuyu орбитален, с две стрелки - атомна орбитална с два електрона, т.е. изцяло населен орбитална без стрелки - .. свободна орбитална, т.е. без електрони.
Атомна орбитална със сферична симетрия (виж фиг. 3) може да бъде определен като S-орбиталния (S-AB). и електроните, които се съдържат в него - като S-електрони.
Радиусът на атомната S-орбитални се увеличава с увеличаване на броя ниво на енергия; 1s-AB се намира във вътрешността на 2s-АО, последният - в SA-3 мастни киселини и т.н. центъра отговорен атомното ядро. Като цяло структурата на електрони обвивка на атома в орбитален модел изглежда пластове. Всяко ниво на енергия съдържа електрони, геометрично разглеждат като електрон слой.
За съкратено обозначение на електрон заемащ атомен S-орбитални, обозначението се S-AO с горния цифров индекс показва броя на електрони. Например, 1s - електронен наименование единичен водороден атом.
брой Енергийно ниво отговаря на основното квантово число, както и вида на орбитална - орбитален брой размер.
2s Li = 1s 2s. Бъдете = 1s 2s
Електронни формула в комбинация с енергия схема на електронната обвивка на атома (фиг. 3) отразява неговата електронна конфигурация.
Атомна орбитална с въртене (аксиална) симетрия обикновено обозначена като Р-орбиталния (р AOS) (Фигура 3). има електрони - електрони е стр.
Всяка р-орбитален на атомната може да получи (при максималната пълнеж) два електрона, като всяка друга AO. Тези електрони заедно заемат две половини р орбити. На всяко ниво атомна енергия (с изключение на първия) има три атомни орбитали, което съответства на максималната утаяване шест електрони.
Фиг. 4. схема на електронната енергийните състояния на атома
Всички три р AOS ниво енергия различно пространствено подреждане; собствената си ос, преминаваща през двете половини и орбитална перпендикулярна на неговата възлова равнина, образуват Декартова координатна система (виж собствени оси X, Y, Z). Ето защо, на всяко ниво на енергия има набор от три атомни р-орбитали: пиксела -, пг - ЗЗ и AOS. Буквите X, Y, Z отговарят на магнитното квантовата номер. дава индикация на влиянието на външното магнитно поле на електрони обвивка на атома.
Атомна орбитала са S-всички енергийни нива, атомни р орбитали - на всички нива, с изключение на първия. На третия и следващите нива на енергия към една S-AO и три р AOS присъединява пет атомни орбитали, наречени г орбитали (Фигура 4), а четвъртата и следващите нива - седем атомни орбитите, наречени F орбити.
2.3. енергийни поднива
много-електрон атома. принципи
изграждането на електрони обвивка
Квантовата механични изчисления показват, че в много-електрон атома, един енергийно ниво електрон не е еднаква; електроните запълват атомни орбитали от различни видове и имат различна енергия.
Нивото на енергия се характеризира с главно квантово число. За всички известни елементи на стойност п варира от 1 до 7. електроните в атома на multielectron се намира в състояние на земята (без напрежение), заета енергийни нива от първи до седми.
Енергийна подниво се характеризира с орбиталната квантово число л. За всяко ниво (п = конст) квантово число л взема всички цели числа от 0 до (п-1), например, когато п = 3 L стойности са 0, 1 и 2. орбитален квантовата номер определя геометрична форма (симетрия) и орбитали -, р-, d-, е -podurovnya. Очевидно е, че във всички случаи, п> л; когато п = 3, максималната стойност на л е 2.
Съществуващите поднива за първите четири на енергийните нива на атомна орбитала и електрони тях са дадени в таблица 1.
Моделът на пълнене на електронен слой атоми се определя от принципа на забрана, предвидена в 1925 от швейцарски физик Pauli.
Принципът на Паули. в един атом не може да бъде два електрона в идентични състояния.
електроните разликата заемащи различни атомна орбитала един подниво (п, L = конст), с изключение на S-подслой, характеризиращ се с магнитно квантово число м. Този номер е известен като магнитно както го характеризира поведението на електроните във външно магнитно поле. Ако стойността на L определя геометричната форма на атомната орбитали подслой, стойността на квантовата номер м установява взаимно пространствено подреждане на тези орбити.